Lancement d’un numéro national d’information sur l’IVG
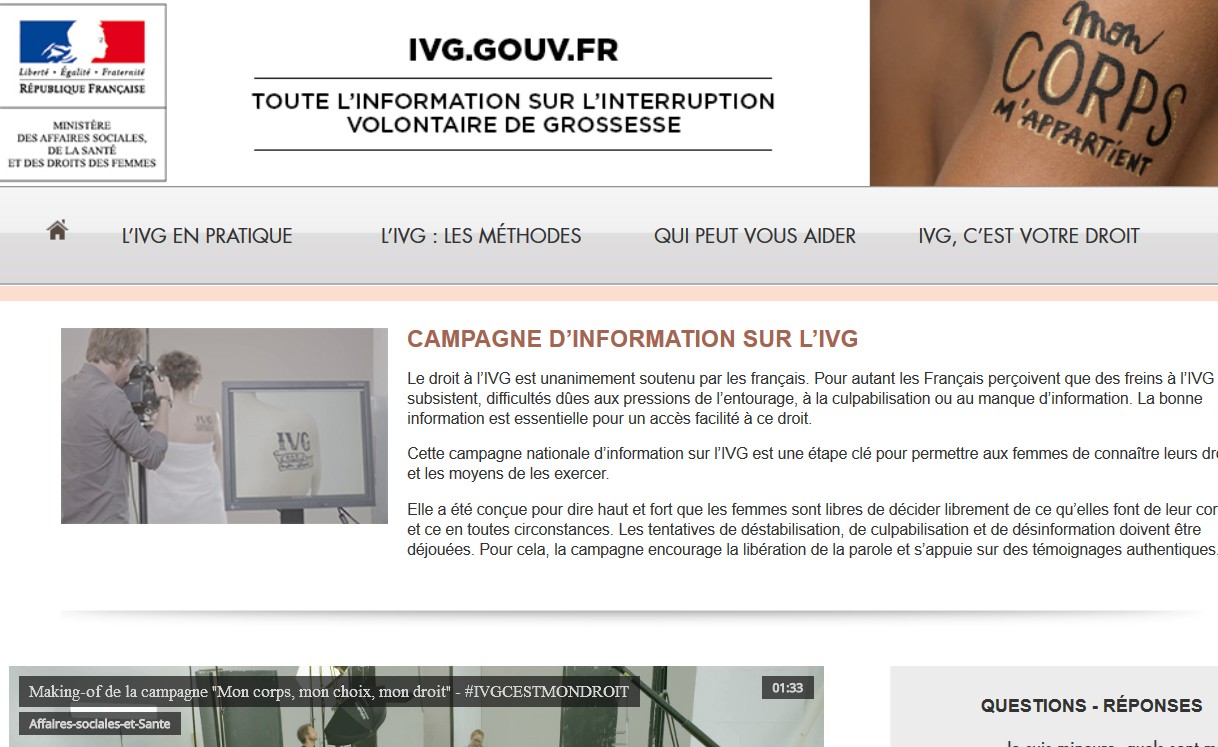 Marisol Touraine, la ministre des Affaires sociales, de la Santé et des Droits des femmes, a annoncé lundi le lancement d’un numéro national d’information sur l’IVG et d’une campagne de communication sur le droit des femmes à disposer de leur corps.
Marisol Touraine, la ministre des Affaires sociales, de la Santé et des Droits des femmes, a annoncé lundi le lancement d’un numéro national d’information sur l’IVG et d’une campagne de communication sur le droit des femmes à disposer de leur corps.
Lancé à l’occasion de la journée mondiale pour le droit à l’avortement, le numéro national anonyme et gratuit, le 0800 08 11 11*, permet dès aujourd’hui de répondre auxdemandes d’information, de conseil, de soutien et d’orientation en matière d’IVG, mais aussi de sexualité et de contraception. « Ce numéro, confié au Mouvement français du planning familial, garantit des informations neutres et objectives sur les droits sexuels et reproductifs des femmes », explique le ministère.
Des annonces presse et une vidéo seront diffusées pendant deux mois dans la presse écrite et sur les réseaux sociaux. Une affiche sera mise à disposition des établissements et professionnels de santé ainsi que des associations accueillant des femmes en demande d’IVG. Le site www.ivg.gouv.fr a également été refondu et enrichi de nouveaux contenus.
De nouvelles mesures pour faciliter l’accès à l’IVG
La ministre a rappelé lundi qu’elle défendait ainsi de nouvelles mesures dans le cadre du projet de loi de modernisation du système de santé, actuellement en cours d’examen au Sénat. Ce projet prévoit notamment de permettre aux sages-femmes de pratiquer des IVG médicamenteuses et aux centres de santé de pratiquer des IVG instrumentales ainsi que la suppression du délai de réflexion de 7 jours entre les deux consultations médicales prévues par la loi.
« Comme 9 Français sur 10, je considère que le droit à l’avortement est un droit fondamental des femmes. Avec ce numéro national et cette campagne de communication, j’ai voulu dire aux femmes qu’elles peuvent décider librement de ce qu’elles font de leur corps. Il est important de le réaffirmer : pas de jugement, pas de pression, pas de désinformation. », a déclaré Marisol Touraine.
* Le 0800 08 11 11 est un numéro anonyme et gratuit, ouvert du lundi au samedi (de 9h à 22h le lundi, de 9h à 20h le reste de la semaine.
