Stratégie nationale de santé : un tableau de bord pour mesurer les résultats
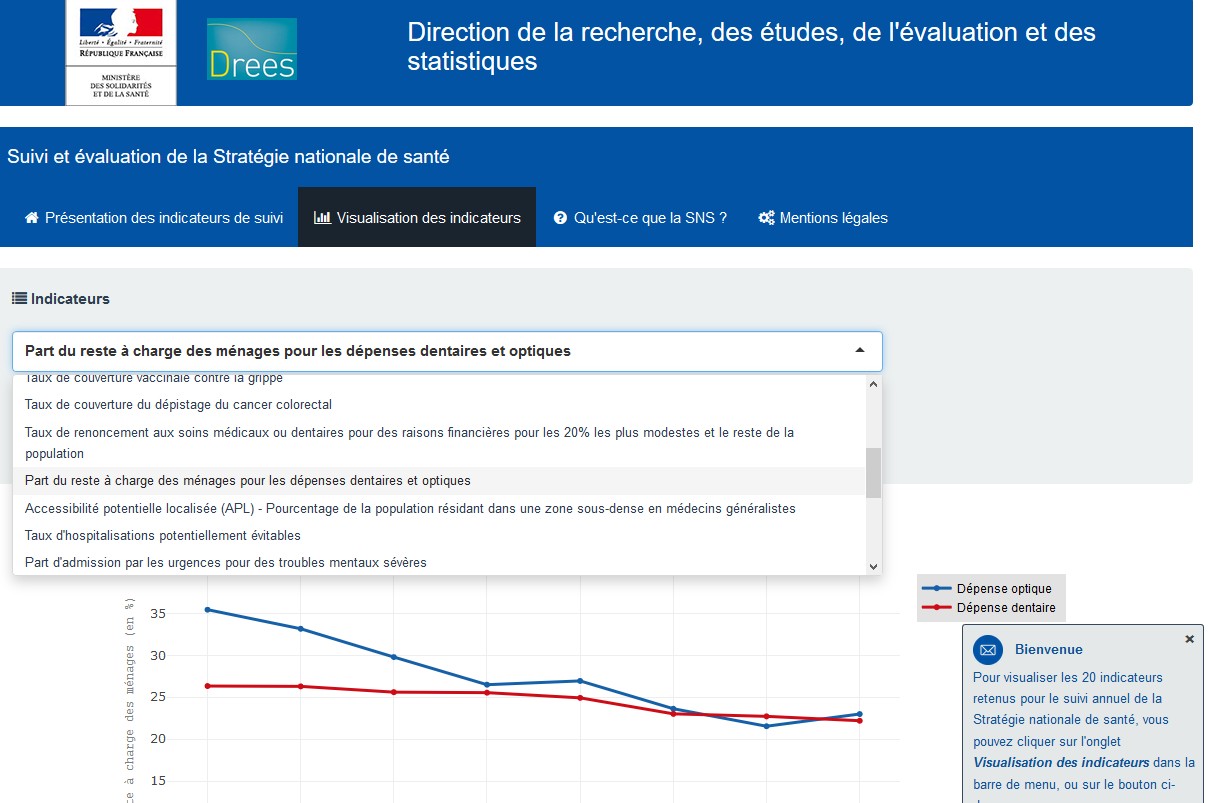 Les équipes de la Direction de la recherche, des études, de l’évaluation et des statistiques (DREES) ont développé une application permettant de visualiser l’évolution des 20 indicateurs de résultats et d’impact retenus avant le déploiement de la Stratégie nationale de santé (SNS) 2018-2022.
Les équipes de la Direction de la recherche, des études, de l’évaluation et des statistiques (DREES) ont développé une application permettant de visualiser l’évolution des 20 indicateurs de résultats et d’impact retenus avant le déploiement de la Stratégie nationale de santé (SNS) 2018-2022.
Le suivi et les évaluations pluriannuels de la Stratégie nationale de santé 2018-2022, adoptée par le Gouvernement en décembre 2017, ont été confiés à la DREES. Pour ce faire, une liste de 20 indicateurs de résultats et d’impact ont été identifiés en tenant compte des différents déterminants de santé, y compris le système de soins. Le suivi de cette sélection restreinte d’indicateurs permettra à tous d’apprécier, de manière transparente, leurs évolutions, sur les axes prioritaires des politiques de santé.
La Stratégie nationale de santé réaffirme le principe porté par l’Organisation Mondiale de la Santé, selon lequel la santé doit être un objectif de toutes les politiques publiques menées en France et dans le monde. À ce titre, le Comité interministériel de la Santé a pour mission de promouvoir la santé dans l’ensemble des politiques publiques. Il s’est réuni le 25 mars 2019 pour présenter les 25 mesures-phares de la politique de prévention destinées à accompagner les Français pour rester en bonne santé tout au long de leur vie.
Les 20 indicateurs retenus par la DREES, à l’issue d’un processus de concertation, permettront d’assurer un suivi pluriannuel de l’ensemble des 4 axes de la SNS, et de ses volets spécifiques. Les équipes de la DREES ont ainsi développé une application permettant de visualiser l’évolution des 20 indicateurs retenus avant le déploiement de la SNS, sur la période récente (entre 2010 et 2017 selon les indicateurs). Par exemple, l’application présente l’évolution de la prévalence du tabagisme quotidien chez les adultes entre 2010 et 2017 (de 30 % à 27 %). La mise à jour de cet indicateur pour la période 2018-2022 permettra de rendre compte de son évolution à la suite des actions visant à promouvoir la santé, incluant la prévention dans tous les milieux et tout au long de la vie (axe 1 de la SNS) en comparant les données avant et après déploiement de la SNS.
Consultez le site « Suivi et évaluation de la Stratégie nationale de santé » : http://dataviz.drees.solidarites-sante.gouv.fr/suivi-sns/
