Bilan du progrès thérapeutique du Leem: 43 nouveaux médicaments en 2012
 Le Leem (Les Entreprises du Médicament) a publié mercredi son bilan annuel du progrès thérapeutique. 43 nouveaux médicaments ou associations de médicaments ont été autorisés ou ont reçu une opinion favorable du Comité européen des médicaments à usage humain en 2012. Un chiffre en légère hausse par rapport aux 41 médicaments du bilan 2011.
Le Leem (Les Entreprises du Médicament) a publié mercredi son bilan annuel du progrès thérapeutique. 43 nouveaux médicaments ou associations de médicaments ont été autorisés ou ont reçu une opinion favorable du Comité européen des médicaments à usage humain en 2012. Un chiffre en légère hausse par rapport aux 41 médicaments du bilan 2011.
Selon le Leem, « l’innovation thérapeutique ne faiblit pas ». Les 43 traitements autorisés ou ayant reçu une opinion favorable du Comité européen des médicaments à usage humain (CHMP) couvrent 18 aires thérapeutiques. Sans surprise, à l’instar des précédents bilans thérapeutiques, les champs de la cancérologie et des maladies rares concentrent à eux seuls près de 40% des progrès thérapeutiques évalués (17 sur un total de 43, dont 11 pour le seul domaine de la cancérologie).
A noter que l’onco-hématologie reste une aire particulièrement innovante, qui compte en 2012, pour la moitié des progrès recensés en cancérologie. Ainsi 5 médicaments ont été autorisés en 2012 pour traiter la maladie de Hodgkin résistante, la leucémie aiguë myéloïde, la myélofibrose, le lymphome non hodgkinien et la leucémie aiguë lymphoblastique.
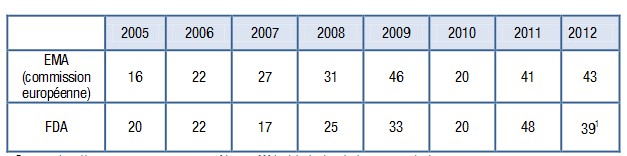
– 43 nouveaux médicaments ont été autorisés en Europe par l’EMA et 39 aux Etats Unis par la FDA, des chiffres stables par rapport aux années précédentes (le chiffre de 43 recouvre les autorisations de l’EMA 2012 et les opinons favorables 2012 du CHMP) :
Beaucoup de premières en 2012 : premier médicament ciblé contre la mucoviscidose, premier médicament ciblé contre le syndrome de Cushing, premier médicament de diagnostic contre la maladie d’Alzheimer, premiers antidiabétiques d’une nouvelle classe, premiers antibiotiques également d’une nouvelle classe, premier vaccin contre le méningocoque B pour les enfants à partir de 2 mois.
Mucoviscidose : ce premier médicament contre une mutation spécifique de cette maladie, qui touche seulement 4% des malades atteints dans le monde, symbolise à lui seul le nouvel modèle de recherche des industriels du médicament : plus ouvert, plus collaboratif, partant du patient et du mécanisme déficient pour élaborer un médicament presque sur mesure.
Vers une médecine « stratifiée »
Selon le Leem, la médecine se déplace progressivement de l’aval et du traitement des symptômes de la maladie vers l’amont et le traitement des causes de la maladie. Cette médecine dite « stratifiée » puisqu’elle décompose en strates, la population des patients atteints d’une même maladie, permet d’affiner considérablement la prise en charge des malades, avec en arrière-plan, cependant, la nécessité d’organiser un modèle économique pérenne et un écosystème d’innovation adapté.
C’est dans cette perspective qu’Hervé Gisserot, Président du Leem, a rappelé « la volonté des industriels d’accélérer le dialogue et la concertation autour de quatre grands chantiers : la simplification et la cohérence administrative, l’attractivité de la France pour les études cliniques, la cohérence entre développement et valorisation de l’innovation et la confiance dans le médicament et le système de soins ».
Le Leem estime ainsi que « le Comité de filière et le Conseil stratégique des industries de santé (CSIS), deux rendez-vous clés de 2013, seront l’occasion de les faire avancer pour que la France se dote d’un cadre stable, lisible et prédictible, propice à l’innovation ». « Dans la compétition mondiale dans les sciences de la vie, la constitution d’un écosystème fertile de l’innovation est la condition du maintien en France d’une filière santé performante et d’un accès rapide des patients au progrès thérapeutique » a conclu Hervé Gisserot.
Source : Leem
