Grippenet.fr : 5 800 volontaires inscrits au nouveau système de surveillance et de recherche
 Actuellement, plus de 5 800 volontaires se sont déjà inscrits et participent à ce nouveau système de surveillance et de recherche, lancé par l’Inserm, l’Université Pierre et Marie Curie et l’Institut de veille sanitaire. GrippeNet.fr est actuellement, en France, le seul système permettant d’étudier les syndromes grippaux chez ces personnes malades qui ne consultent pas de structure médicale.
Actuellement, plus de 5 800 volontaires se sont déjà inscrits et participent à ce nouveau système de surveillance et de recherche, lancé par l’Inserm, l’Université Pierre et Marie Curie et l’Institut de veille sanitaire. GrippeNet.fr est actuellement, en France, le seul système permettant d’étudier les syndromes grippaux chez ces personnes malades qui ne consultent pas de structure médicale.
Le 27 février, les données de la surveillance de la grippe confirmaient le franchissement du pic épidémique de la grippe saisonnière. Le site Internet www.grippenet.fr permet pour la deuxième année consécutive de collecter des données sur les syndromes grippaux directement auprès de la population française.
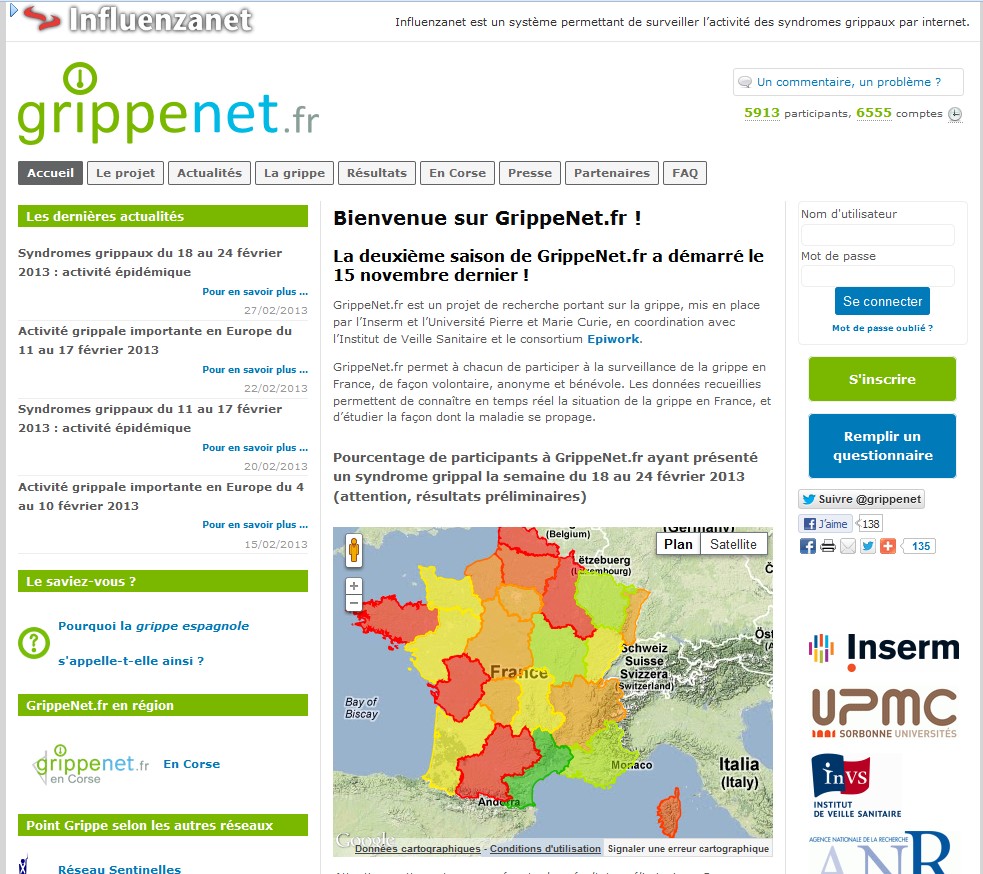
Depuis le début de l’épidémie, le pourcentage de participants de GrippeNet.fr déclarant des symptômes compatibles avec un syndrome grippal a augmenté, passant de 1,2% des participants par semaine fin décembre à 2,5% début février. La semaine dernière, les principaux signes déclarés étaient le nez qui coule ou bouché (13,1% des participants), de la toux (10,3%), des éternuements (8,5%) et des maux de gorge (7,6%). Les régions dans lesquelles les participants étaient les plus nombreux à déclarer des symptômes de syndrome grippal étaient Poitou-Charentes (6% des participants), Nord-Pas-de-Calais (5,9%) et Bretagne (3,5%).
Depuis le début de l’épidémie, 62% des participants de GrippeNet.fr atteints d’un syndrome grippal ne sont pas allés consulter de structure médicale. Depuis le démarrage de la deuxième saison, plus de 2 000 nouvelles personnes se sont inscrites pour participer à cette étude, et près de 4 000 personnes déclarent actuellement chaque semaine les symptômes qu’elles ont eus ou non depuis leur dernière connexion. La moyenne d’âge des participants de la deuxième saison de GrippeNet.fr est actuellement de 45 ans, et 62% des participants sont des femmes. Les départements dans lesquels la participation est la plus importante sont la Haute-Corse, la Corse du Sud et Paris.
Vous résidez en France et vous souhaitez participer à la surveillance de la grippe ? Rendez-vous sur www.grippenet.fr

