Médicament: la balance commerciale atteint un niveau record en 2010
 Dans un contexte marqué par une intensification de la concurrence économique entre les Etats, le secteur du médicament enregistre un nouveau record en terme d’excédent commercial pour l’année 2010. Cet excédent s’élève à 7,2 milliards d’euros (contre 6,8 milliards d’euros en 2009), selon les dernières statistiques douanières, indique le Leem dans un communiqué.
Dans un contexte marqué par une intensification de la concurrence économique entre les Etats, le secteur du médicament enregistre un nouveau record en terme d’excédent commercial pour l’année 2010. Cet excédent s’élève à 7,2 milliards d’euros (contre 6,8 milliards d’euros en 2009), selon les dernières statistiques douanières, indique le Leem dans un communiqué.
Les exportations françaises de médicaments ont ainsi augmenté en 2010, atteignant 24 milliards d’euros (contre 23 milliards d’euros en 2009), soit une croissance de 4 %. Les importations de médicaments par la France demeurent à un niveau inférieur et s’établissent à 16,8 milliards d’euros en 2010 (16,3 milliards d’euros en 2009), soit une hausse de 3 % seulement. Au total, le médicament constitue la 4ème source de rentrées de devises pour l’économie française.
Dans un contexte de tassement des effectifs du secteur (- 1,7 % en 2009), essentiellement dû aux restructurations impactant les métiers du marketing/vente et les fonctions support, l’emploi en production a crû de + 2,2 % en 2009. « Cette évolution significative traduit bien les efforts et la volonté de la profession de maintenir et de développer l’emploi en France », soulignent les Entreprises du Médicament dans un communiqué.
« La politique de réindustrialisation, initiée en 2009 au travers d’une approche contractuelle avec les pouvoirs publics, porte ses fruits, en dépit d’un environnement globalement défavorable pour le secteur, commente Christian Lajoux, le Président du Leem. La volonté de maintenir et créer de l’emploi industriel en France, en facilitant notamment le développement du façonnage sur le territoire national, dans un contexte économique et social en forte mutation, contribue à ces bons résultats. Les entreprises du médicament représentent un secteur d’activité stratégique pour le pays et un facteur de sortie de crise ».
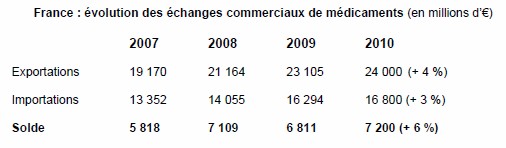
Source : Leem
