Novartis : Joe Jimenez nommé au poste de Directeur général
 Parallèlement à la présentation de ses résultats 2009, Novartis se choisit un nouveau Directeur général et simplifie l’organisation de sa haute direction. Le Conseil d’administration a nommé à ce poste Joe Jimenez, actuellement directeur de la division Pharmaceuticals. Une nomination effective à compter du 1er février 2010. Daniel Vasella se concentrera quant à lui sur les priorités stratégiques en tant que Président du Conseil d’administration.
Parallèlement à la présentation de ses résultats 2009, Novartis se choisit un nouveau Directeur général et simplifie l’organisation de sa haute direction. Le Conseil d’administration a nommé à ce poste Joe Jimenez, actuellement directeur de la division Pharmaceuticals. Une nomination effective à compter du 1er février 2010. Daniel Vasella se concentrera quant à lui sur les priorités stratégiques en tant que Président du Conseil d’administration.
Joe Jimenez va succéder ainsi au poste de Directeur général de Novartis à Daniel Vasella, qui a été au service de la société pendant quatorze ans comme Directeur général et onze ans en tant que Président et Administrateur délégué. Une nomination qui achève le processus de succession qui a débuté en 2008 par la création d’un poste de transition de Directeur opérationnel et la désignation d’un nouveau management à l’échelon des divisions.
« (…) L’expérience internationale de Joe Jimenez dans les domaines des produits pharmaceutique et de la grande consommation alliée à l’excellence de sa carrière le prédestinent à diriger Novartis dans la prochaine phase d’expansion et de croissance. Je suis certain que 2010 verra l’accomplissement de grands progrès.», a déclaré Daniel Vasella dans un communiqué.
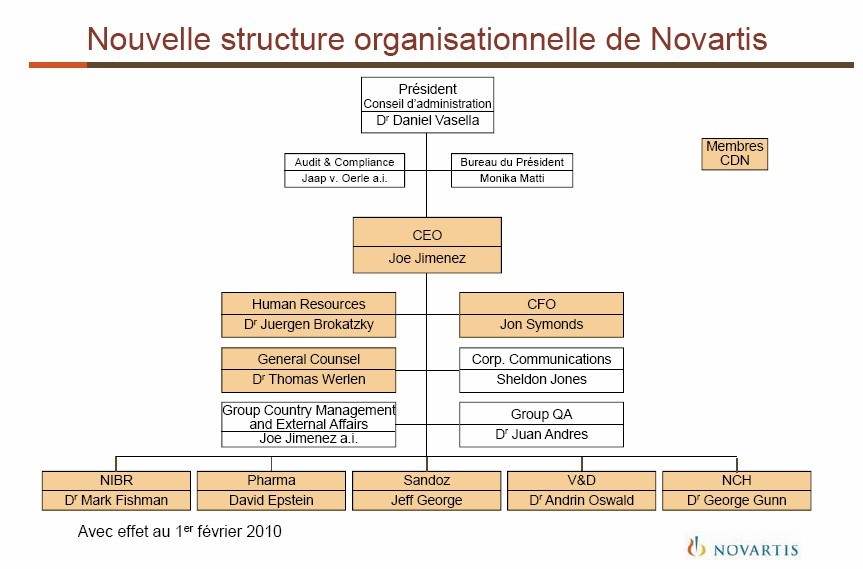
Autres remaniements au sein de la direction du groupe, David Epstein, actuellement directeur du domaine thérapeutique stratégique Oncologie, l’unité qui enregistre la croissance la plus rapide au sein de Pharmaceuticals, prendra la direction de la division Pharmaceuticals. Jon Symonds deviendra, le 1er février 2010, Directeur financier, succédant à Raymund Breu, qui se retirera le 31 mars, atteint par la limite d’âge.
Simplifiant la structure de sa haute direction, Novartis réduit la taille du Comité de direction de douze à neuf membres. Il sera composé de: Joe Jimenez, Directeur général, Dr Mark Fishman, , Directeur Monde NIBR (The Novartis Institute for BioMedical Research); David Epstein, Directeur de la division Pharmaceuticals, Jeff George, Directeur de la division Generics, George Gunn, Directeur de la division Consumer Health, Dr Andrin Oswald, Directeur de la division Vaccins et Diagnostic; Jon Symonds, Directeur finanier, Thomas Werlen, General Counsel et Jürgen Brokatzky-Geiger, Directeur Monde des Ressources Humaines.
« Dans la poursuite des efforts visant à aplatir la hiérarchie », trois positions dirigeantes ont été éliminées: direction opérationnelle, direction Corporate Affairs et direction Opérations technique et Qualité du Groupe. Deux unités plus petites, Assurance qualité du Groupe, dirigée par Juan Andres et Direction pays/Affaires extérieures du Groupe, conduite par intérime par Joe Jimenez, sont placées sous la responsabilité du Directeur général. L’unité Corporate Audit and Compliance rend compte au Président du Conseil d’administration.
Tous ces changements prendront effet au 1er février 2010.
Cliquez sur l’image pour agrandir :
Source : Novartis