Accès aux Médicaments : le classement 2016 des laboratoires pharmaceutiques
 L’Indice d’Accès aux Médicaments (Access to Medicines Index) 2016, publié lundi, établit un classement des 20 principaux laboratoires pharmaceutiques en fonction des efforts qu’ils accomplissent afin d’améliorer l’accès aux médicaments dans les pays à faibles et moyens revenus. GSK arrive en tête du classement pour la 5ème fois suivi par un groupe compact comprenant Johnson & Johnson, Novartis et Merck KGaA.
L’Indice d’Accès aux Médicaments (Access to Medicines Index) 2016, publié lundi, établit un classement des 20 principaux laboratoires pharmaceutiques en fonction des efforts qu’ils accomplissent afin d’améliorer l’accès aux médicaments dans les pays à faibles et moyens revenus. GSK arrive en tête du classement pour la 5ème fois suivi par un groupe compact comprenant Johnson & Johnson, Novartis et Merck KGaA.
Cet indice est publié tous les deux ans par l’Access to Medicine Foundation, un organisme indépendant à but non lucratif financé par la Fondation Bill et Melinda Gates, le Ministère Néerlandais des Affaires Étrangères et le Département pour le Développement International du Royaume-Uni.
Cet indice classe les laboratoires « en fonction de leurs efforts d’amélioration de l’accès aux médicaments, l’évaluation portant sur sept domaines comportementaux. Il identifie les meilleures pratiques, met en lumière les domaines faisant l’objet d’améliorations et ceux dans lesquels des actions importantes restent nécessaires », précise l’Access to Medicine Foundation.
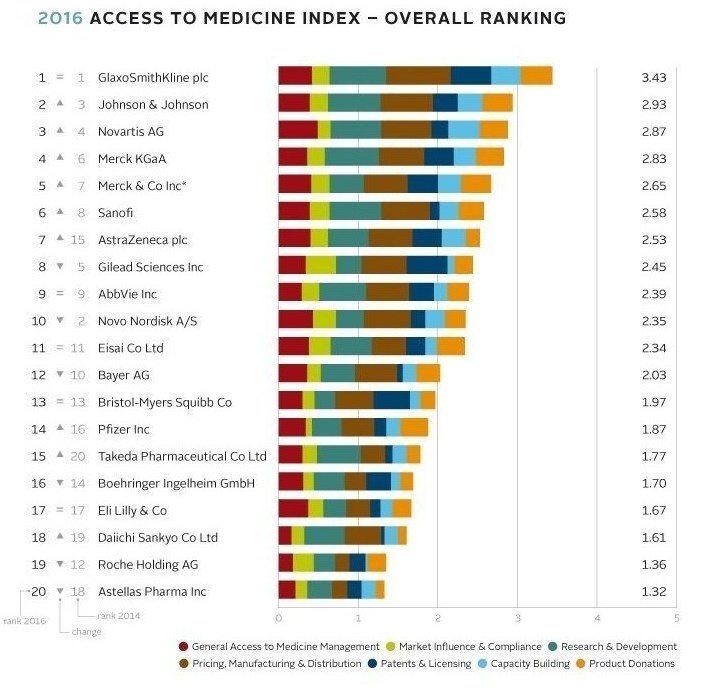
Concernant les quatre laboratoires du groupe de tête, l’Access to Medicine Foundation estime qu’ils « partagent certaines caractéristiques. Ils disposent des programmes d’accès les plus aboutis et de stratégies d’accès aux médicaments bien organisées soutenant le développement d’activités sur les marchés émergents, là où les besoins en accès aux médicaments sont élevés. Ce sont également eux qui montrent le plus qu’ils répondent à des besoins hautement prioritaires identifiés de façon indépendante ».
L’indice indique que mes laboratoires dont le classement a le plus amélioré sont AstraZeneca et Takeda ; ces deux laboratoires ont considérablement développé et renouvelé leurs stratégies d’accès. AstraZeneca a ainsi gagné huit places dans le Top 10 et est arrivé en 7ème position, tandis que Takeda a gagné cinq places, arrivant en 15ème position. Après avoir été dépassés par leurs confrères, Novo Nordisk, Roche et Gilead ont quant à eux enregistré la plus forte chute dans le classement.
Les laboratoires commercialisent 850 produits pour les 51 maladies représentant le plus lourd fardeau dans les pays à faibles et moyens revenus, et en développent 420 autres. Cela inclut plus de 100 produits dont le développement a commencé en 2014 et 151 produits à faible incitation commerciale, mais dont le besoin est urgent, principalement pour les populations pauvres.
La mise en place de modèles de R&D collaboratifs
La majorité (67%) des projets de recherche concernant des produits à haute priorité et à faible incitation commerciale sont menés par les laboratoires dans le cadre d’un partenariat, révèle l’indice.
« Nous avons trouvé que les modèles de R&D collaboratifs incitent l’industrie à développer des médicaments dont le besoin est urgent et qui autrement n’auraient pas été pris en compte en raison de leur faible débouché sur le marché », explique Jayasree K. Iyer, Directeur exécutif de l’Access to Medicine Foundation. « L’approche de partenariat fonctionne. »
Depuis 2014, sept laboratoires ont publié des promesses nouvelles ou élargies selon lesquelles ils renonceront à leurs droits de brevet pour certains produits dans certaines régions. Davantage de produits contre le VIH/SIDA sont couverts par des licences volontaires, qui s’appliquent dans plus de pays qu’auparavant. Et, pour la première fois, ces licences sont utilisées pour élargir l’accès aux médicaments pour une maladie autre que le VIH/SIDA : l’hépatite C. Dans le monde, de 130 à 150 millions de personnes souffrent d’une hépatite C chronique.
Cependant, un produit ne peut être commercialisé dans un pays que s’il a été enregistré dans celui-ci. L’indice révèle que, pour leurs produits les plus récents, les laboratoires ne déposent une demande d’enregistrement que dans 25 % des pays identifiés par l’indice comme étant les plus prioritaires.
Rendre ces produits plus abordables économiquement
L’Indice révèle que les systèmes de tarification qui prennent en compte la capacité de payer sont appliqués à un tiers des produits concernés. Cet état de fait n’a pas changé depuis le dernier indice publié il y a deux ans. Seuls 5% des produits (44 sur 850) se voient appliquer ces stratégies de tarification dans les pays identifiés par l’indice comme étant les plus prioritaires, avec au moins un facteur socio-économique pris en compte. La plupart de ces produits sont des produits de GSK, d’AstraZeneca et de Sanofi.
L’indice révèle par ailleurs les autres éléments suivants :
– Un quart des laboratoires (5) mettent en place de nouveaux modèles d’affaire dont le but est d’atteindre les populations à faibles et moyens revenus.
– Les maladies faisant l’objet d’une attention particulière dans le cadre des activités des laboratoires visant à favoriser l’accès aux médicaments sont les cardiopathies, les infections des voies respiratoires inférieures et le VIH/SIDA. La R&D se concentre toujours sur cinq maladies, la priorité étant donnée aux infections des voies respiratoires inférieures, suivies du diabète, du paludisme, de l’hépatite virale et du VIH/SIDA.
– La plupart des laboratoires travaillent au renforcement des systèmes de santé dans les pays à faibles et moyens revenus. Six d’entre eux adaptent en permanence ces activités aux priorités identifiées par les acteurs locaux, notamment les gouvernements.
« Cela fait maintenant 10 ans que nous évaluons ces 20 laboratoires. Nous savons ce qui fonctionne, et où. Des bonnes pratiques sont désormais en place : là où des mécanismes visant à encourager l’implication de l’industrie pharmaceutique, tels que la mise en commun de brevets, la mise en place de modèles de R&D collaboratifs, des initiatives multipartites et des engagements internationaux par rapport à certaines maladies existent, nous constatons que l’industrie répond présente », a déclaré Jayasree K. Iyer. « L’accès aux médicaments constitue une responsabilité collective et toutes les parties concernées – de l’industrie pharmaceutique aux gouvernements en passant par la communauté sanitaire mondiale – doivent se mettre au défi de favoriser le développement de ces efforts afin de s’assurer qu’ils concernent de plus en plus de produits, dans de plus en plus de pays, le but étant que ceux qui en ont besoin puissent accéder aux produits pharmaceutiques. »
Source : Indice d’Accès aux Médicaments

