CarThera : des ultrasons pour mieux traiter les pathologies cérébrales
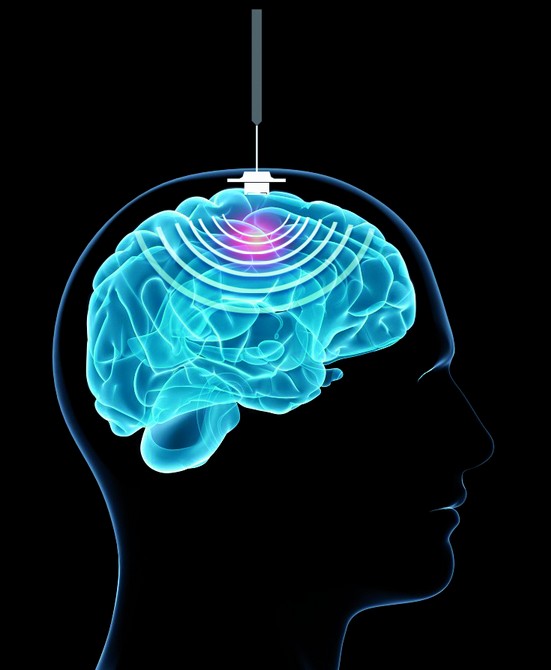 CarThera, société française basée à l’Institut du Cerveau et de la Moelle épinière (ICM), vient d’annoncer en association avec l’Assistance Publique – Hôpitaux de Paris (AP-HP) et l’Université Pierre et Marie Curie (UPMC), la publication d’un article scientifique* sur les tous premiers franchissements de la Barrière Hémato-Encéphalique (BHE), grâce aux ultrasons, dans la revue Science Translational Medicine.
CarThera, société française basée à l’Institut du Cerveau et de la Moelle épinière (ICM), vient d’annoncer en association avec l’Assistance Publique – Hôpitaux de Paris (AP-HP) et l’Université Pierre et Marie Curie (UPMC), la publication d’un article scientifique* sur les tous premiers franchissements de la Barrière Hémato-Encéphalique (BHE), grâce aux ultrasons, dans la revue Science Translational Medicine.
La perméabilisation temporaire des vaisseaux sanguins cérébraux par ultrasons permet une diffusion accrue des molécules thérapeutiques, et notamment des chimiothérapies, qui, le plus souvent, pénètrent insuffisamment dans le cerveau. Cette première mondiale, réalisée à l’hôpital de la Pitié-Salpêtrière, ouvre des perspectives thérapeutiques importantes pour les cancers du cerveau, mais également pour des pathologies neuro-dégénératives comme la maladie d’Alzheimer, pour lesquelles des molécules efficaces ne pouvaient pas jusqu’alors pénétrer dans le cerveau.
« La Barrière Hémato-Encéphalique (BHE) est une des dernières frontières majeures en neurosciences. La publication des résultats de notre étude dans l’un des plus prestigieux journaux scientifiques américains* constitue une belle reconnaissance pour cette première médicale », explique le Professeur Alexandre Carpentier, neurochirurgien à l’hôpital de la Pitié–Salpêtrière, inventeur du dispositif SonoCloud et fondateur de la société CarThera.
« Cette publication scientifique valide le concept de SonoCloud et va nous permettre de démarrer les prochaines étapes cliniques en vue de la commercialisation du dispositif. Nous prévoyons de lever des fonds en 2017 pour financer un essai clinique de phase 2b/3 de grande envergure qui inclura environ 200 patients, avec des centres en Europe et aux Etats-Unis », déclare Frédéric Sottilini, Directeur Général de CarThera. « SonoCloud pourrait alors être mis sur le marché en 2020 pour l’indication glioblastome en récidive, le temps d’obtenir le marquage CE et l’approbation FDA. En parallèle, la société réalisera des études exploratoires dans d’autres indications, dont la maladie d’Alzheimer. »
Selon les estimations de la société, à l’échelle mondiale, parmi les 250 000 patients diagnostiqués chaque année d’une tumeur du cerveau, plus de 160 000 pourraient bénéficier de l’innovation SonoCloud (principalement des cancers primitifs du cerveau et certaines métastases cérébrales d’autres cancers). Cela représente un marché de 1,5 milliard d’euros.
* L’article scientifique “Clinical trial of blood-brain barrier disruption by pulsed ultrasound” a été publié dans la revue Science Translational Medicine du 15 juin 2016, éditée par l’AAAS (Association américaine pour l’avancement des sciences), une des plus grandes fédérations d’organisations scientifiques dans le monde.
Source et visuels: CarThera
