Industrie pharmaceutique : 1ère progression des effectifs depuis dix ans
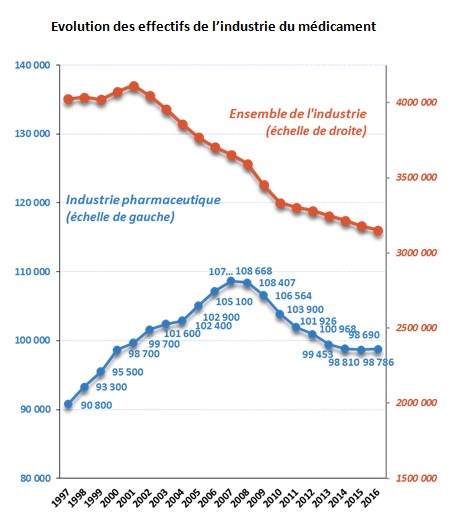
 Selon les résultats de la dernière enquête annuelle Emploi du Leem, la stabilisation des effectifs de l’industrie pharmaceutique en France se confirme. Avec 98 786 salariés recensés à fin 2016, soit une progression des effectifs de 0,1 %, l’industrie pharmaceutique bénéficie d’une trajectoire de l’emploi légèrement plus favorable que celle observée dans l’ensemble de l’industrie manufacturière (- 0,9 %).
Selon les résultats de la dernière enquête annuelle Emploi du Leem, la stabilisation des effectifs de l’industrie pharmaceutique en France se confirme. Avec 98 786 salariés recensés à fin 2016, soit une progression des effectifs de 0,1 %, l’industrie pharmaceutique bénéficie d’une trajectoire de l’emploi légèrement plus favorable que celle observée dans l’ensemble de l’industrie manufacturière (- 0,9 %).
Il s’agit pour le secteur de la première progression des effectifs depuis dix ans. Cette tendance semble se confirmer pour 2017 avec, selon les premières estimations, une croissance des effectifs de l’ordre de 0,4 %. Cette légère reprise de l’emploi reste toutefois extrêmement modeste au regard des taux de croissance constatés avant 2008 (plus de 108 000 collaborateurs en 2008).
L’enquête révèle toutefois des disparités selon les familles de métiers. Les métiers de la production continuent de progresser avec 470 collaborateurs de plus qu’en 2015 (44 136 en 2016 vs 43 666 en 2015) tandis que les effectifs de commercialisation-diffusion s’inscrivent de nouveau en baisse pour ne représenter plus que 24,8 % de l’emploi du secteur en 2016 contre 31 % dix ans auparavant.
Une industrie qui recrute chez les jeunes
Dans un secteur où l’âge moyen des salariés augmente d’un an tous les 3 ans, les entreprises du secteur misent sur les jeunes. En 2016, la part des moins de 30 ans atteint 14,5 % des effectifs du secteur en intégrant tous les types de contrat. Le nouvel accord collectif sur le contrat de génération conclu en novembre 2016 entre le Leem et quatre organisations syndicales (la CFDT, la CFE-CGC, la CFTC et l’UNSA) porte ses premiers fruits. Cet accord engage les entreprises du médicament à augmenter progressivement la part des jeunes de moins de 30 ans dans les recrutements à hauteur de 30 % et celle des seniors (50 ans et plus) à hauteur de 10 % d’ici trois ans. Le Leem s’est également engagé à réaliser, d’ici la fin du prochain quinquennat (2022), 5 000 contrats d’apprentissage ou de professionnalisation par an. Premier signe visible de cet engagement, 4 100 contrats (apprentissage, professionnalisation et stages en entreprise) ont été conclus en 2016 contre 3 536 en 2015. Des engagements forts de la part des industriels qui demeurent toutefois insuffisants face à la persistance des signaux de décrochage. Ainsi, de plus en plus de petites entreprises ou de sous-traitants font face à des difficultés économiques croissantes liées à la concentration et l’optimisation des métiers de production et de R&D. 61 % des effectifs de R&D sont concentrés dans seulement 10 entreprises en France.
Sans attractivité, pas d’emploi pérenne
De facto, l’industrie du médicament, qui représente plus de 3 % de l’emploi industriel français et bénéficie d’une main d’œuvre qualifiée et d’infrastructures logistiques de grande qualité en production et R&D, souffre aujourd’hui d’un déficit d’attractivité préoccupant. La tendance observée, depuis quelques années, d’une externalisation d’activités vers la prestation (façonniers) se poursuit en France mais aussi à l’étranger. Les activités de R&D subissent également la loi des transferts avec un déplacement des centres de R&D vers des pays plus attractifs, notamment en termes d’efficience de maillage entre public et privé et d’accès au marché. La France est devenue l’un des pays européens les moins attractifs à l’international. Dans de nombreux domaines stratégiques (accès au marché, stabilité de l’environnement fiscal et réglementaire, coût de production, coût de la main-d’œuvre…), l’industrie pharmaceutique française est désormais distancée par l’Allemagne, le Royaume-Uni, l’Italie ou l’Irlande. En Italie, le Premier ministre Matteo Renzi, et son successeur, Paolo Gentiloni ont défini avec les laboratoires pharmaceutiques des objectifs ambitieux visant à renforcer les investissements en santé et à accroître les capacités industrielles nationales. Les résultats ne se sont pas fait attendre. Avec 5 % de croissance annuelle, la production pharmaceutique italienne devrait détrôner le leader allemand courant 2018. Même volontarisme politique outre-manche où la Première ministre Theresa May a lancé un plan de dynamisation industrielle (« Building a Britain fit for the future ») pour relancer l’attractivité du pays et rassurer les investisseurs, dans la perspective de l’après-Brexit. Plusieurs grandes firmes pharmaceutiques ont déjà confirmé des investissements significatifs sur le sol britannique. Les exemples européens le prouvent. Le décrochage français est inquiétant mais pas irrémédiable. Il est encore temps pour l’industrie pharmaceutique de retrouver son leadership en Europe et de consolider durablement la reprise de l’emploi.
« Passé le coup de massue porté par la LFSS pour 2018, il convient de s’atteler rapidement et collectivement à la relance de notre attractivité industrielle. La logique est simple : sans attractivité, pas d’investissement ; sans investissement, pas de recherche ni de production ; et sans recherche et production, pas d’emploi… Il ne peut y avoir de création d’emplois sans perspectives d’avenir et de compétitivité », indique Patrick Errard, président du Leem.
« La stabilisation des effectifs de l’industrie pharmaceutique est une bonne chose mais elle reste très relative, indique, de son côté, Michel Ginestet, Président de la Commission des Affaires sociales du Leem. En 2016, le nombre de collaborateurs de l’industrie pharmaceutique en France est revenu au même niveau qu’en 2000 (98 700). La prudence est de mise : cette stabilité est fragile. Pour consolider l’emploi, il convient d’appliquer la règle des 3C : Compétence, Confiance et Croissance. Les compétences ? Nous les avons. La confiance ? Le gouvernement commence à la restaurer en relançant les travaux du CSIS, instance exclusive de dialogue entre le gouvernement et les industries de la Santé. Ce qu’il nous manque désormais, c’est une croissance économique du secteur pour soutenir nos industries innovantes et créatrices d’emplois. »
Retrouver l’enquête du Leem sur www.leem.org
Source et visuel : Leem
