Nanomédecine : un marché de 129 milliards de dollars en 2016
 Le Comité Biotechnologies du Leem vient de publier l’étude « Applications des nanotechnologies à la médecine : compétitivité et attractivité de la France à l’horizon 2025 » qui donne une photographie globale et prospective du secteur de la nanomédecine en France et dans le monde. Un marché qui pourrait atteindre jusqu’à 129 milliards de dollars en 2016.
Le Comité Biotechnologies du Leem vient de publier l’étude « Applications des nanotechnologies à la médecine : compétitivité et attractivité de la France à l’horizon 2025 » qui donne une photographie globale et prospective du secteur de la nanomédecine en France et dans le monde. Un marché qui pourrait atteindre jusqu’à 129 milliards de dollars en 2016.
L’étude souligne ainsi la part importante de la France dans ce secteur clé de l’innovation « dans le domaine du cancer, avec des traitements plus ciblés et plus efficaces, ainsi que dans les maladies des os et du cartilage, avec la reconstruction des tissus endommagés lors de fractures ». Les « nano » interviennent également dans le domaine des maladies cardiovasculaires ou neurologiques, avec la reconstruction du muscle cardiaque après un infarctus ou la restauration de tissus après un accident vasculaire cérébral.
Selon l’étude, 230 produits de santé constitués d’éléments « nano » forment aujourd’hui l’arsenal thérapeutique, qui se décompose en 184 médicaments, vaccins thérapeutiques et dispositifs médicaux, 18 produits de médecine régénérative, 8 produits d’imagerie, 9 produits de diagnostic in vitro et 11 vaccins prophylactiques.
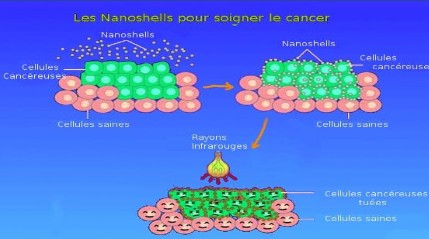
49 produits ont une autorisation de mise sur la marché (on en comptait 36 en 2008) et 122 médicaments de santé humaine sont actuellement en développement clinique (32% en phase II, 3% en phase II/III et 11% en phase III). La grande majorité des produits (70) sont développés dans le domaine du cancer et plus spécifiquement pour améliorer la délivrance des chimiothérapies et réduire leur toxicité.
Nanomédecine : « la France reste un acteur majeur »
L’étude rappelle que la France possède une recherche académique de pointe concentrée autour de deux pôles de visibilité mondiale, le Minatec (Grenoble) et l’Institut Galien (Chatenay-Malabry), puissants aimants d’entreprises de nanomédecine : 30 en 2013 contre 12 en 2008, une augmentation de + 150%. Elle soutient, via les deux vagues, des investissements d’avenir issus du Grand Emprunt (2010 et 2011), 8 projets de nanotechnologies appliquées à la médecine.
L’étude émet cependant quelques réserves. « Pendant la période 2008-2013, nos concurrents européens, l’Allemagne et l’Angleterre, ont avancé à pas de géant, l’Angleterre augmentant de + 211% le nombre d’entreprises de nanomédecine sur son territoire, passant de 9 à 28, et l’Allemagne de + 432%, passant de 19 à 101 entreprises ». Une progression qui s’expliquerait par une fluidité des collaborations académiques-industriels dans les deux pays et un investissement massif des Länder et de l’Etat fédéral allemand dans la nanomédecine, érigée en priorité nationale.
Comme dans les autres champs d’innovation où la France se positionne comme un acteur reconnu mondialement (immunologie, thérapie cellulaire…), l’étude du Leem pointe certaines faiblesses du secteur des nanotechnologies en France : « pas de priorité clairement affichée, des investissements émiettés, une culture française qui ne favorise pas suffisamment l’échange et le partenariat entre chercheurs et industriels ».
L’étude du Comité Biotechnologies du Leem met en avant plusieurs propositions. Elle prône ainsi le développement de l’interdisciplinarité en augmentant les collaborations entre PME et grands groupes pharmaceutiques et en favoriser et développer les parcours mixtes académique /industriel et les transferts de technologie. Autre axe, la promotion des atouts français en capitalisant sur les forces présentes : nano-électronique et systèmes de délivrance. L’étude recommande également le maintien et le renforcement les investissements publics pour pérenniser le secteur. Enfin, elle propose de enforcer et de simplifier les structures publiques de transfert de technologie et de soutien à l’innovation.
Des recommandations, qui rappelle l’étude, s’inscrivent dans la ligne des propositions de la Plateforme européenne de nanomédecine (ou ETP-N). Cette dernière, dans le cadre d’Horizon 2020 (le programme de recherche et d’innovation de l’Union européenne) vient de réaliser une cartographie des acteurs du secteur de la nanomédecine et un livre blanc, avec deux axes stratégiques phares : créer un « translation hub » à destination des petites sociétés de nanomédecine. Ce hub permettrait à la fois une sélection et un accompagnement des projets et créer un système de soutien financier dédié, combiné à la mise en place d’un laboratoire de caractérisation des nanoparticules et dispositifs médicaux utilisant des nanotechnologies (contrôles qualité chimique, biologique, toxicologique, etc) à l’image du Nanotechnolgoy Characterization Laboratory créé aux Etats-Unis en 2004 au sein du National Cancer Institute. Ce laboratoire a caractérisé près de 300 nanoproduits en 10 ans.
L’intégralité de l’étude « Applications des nanotechnologies à la médecine – Compétitivité et Attractivité de la France Horizon 2025 » est téléchargeable à partir du lien suivant : http://www.leem.org/applications-des-nanotechnologies-medecine
Source : Leem

