Traçabilité des produits pharmaceutiques : Adents lève 8,5 millions d’euros
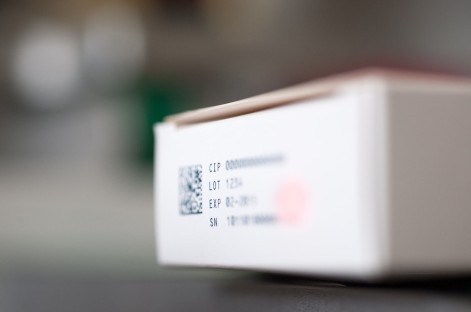 Adents, l’éditeur de logiciels d’identification et de traçabilité unitaire a finalisé au premier trimestre une levée de fonds de 8,5 millions d’euros. Un tour de table qui doit permettre à la PME d’étendre sa présence à l’international et d’assurer le déploiement rapide de son logiciel sur les lignes de conditionnement de produits pharmaceutiques européennes et nord-américaines.
Adents, l’éditeur de logiciels d’identification et de traçabilité unitaire a finalisé au premier trimestre une levée de fonds de 8,5 millions d’euros. Un tour de table qui doit permettre à la PME d’étendre sa présence à l’international et d’assurer le déploiement rapide de son logiciel sur les lignes de conditionnement de produits pharmaceutiques européennes et nord-américaines.
Fondé en 2007 et basée à Massy, Adents est devenu en quelques années un acteur majeur sur le marché français des logiciels d’identification et de traçabilité unitaire de produits, notamment dans le secteur pharmaceutique. Soutenue par BPI France, Adents a bénéficié de près de 15 millions d’euros de financements depuis sa création. Aujourd’hui, plus d’1 milliard de codes uniques ont déjà été générés et pilotés à partir des logiciels Adents, dans l’industrie pharmaceutique et dans d’autres secteurs industriels.
Des échéances réglementaires
« Dans un contexte où les médicaments contrefaits inondent internet et arrivent dans les réseaux de distribution traditionnels, notamment en officine et dans les hôpitaux, mettant des millions de vie en danger, les états des principaux continents ont légiféré. Pour protéger les patients, ils imposent à l’industrie pharmaceutique d’identifier unitairement chaque étui à l’aide d’un code unique. », rappelle la société dans un communiqué. « Cette démarche de sérialisation doit être mise en place sur l’ensemble de la production mondiale de médicaments, représentant plusieurs dizaines de milliers de lignes de conditionnement à mettre en conformité d’ici à début 2018. », poursuit-elle.
Dotés de plus de 25 ans d’expérience dans le domaine de la traçabilité, les fondateurs d’Adents ont développé une nouvelle génération de logiciels qui permettent aux laboratoires et façonniers pharmaceutiques mondiaux de se mettre en conformité avec les réglementations dans les délais impartis et selon les spécificités nationales.
« Seule solution de sérialisation standard du marché, elle offre comme avantage majeur un déploiement rapide et facile, limitant les ruptures de production. Aujourd’hui, déjà plus d’1 milliard de produits en circulation dans le monde ont un code unique généré ou piloté à partir des logiciels Adents. », indique la société.
Une levée pour soutenir sa croissance en Europe et en Amérique du Nord
L’augmentation de capital de 8,5 millions d’euros s’est opérée au premier trimestre auprès de NAXICAP Partners et CapHorn Invest, ses actionnaires historiques, d’Omnes Capital et des membres de la direction. Elle va permettre de soutenir sa croissance en Europe et en Amérique du Nord où elle vient d’ouvrir deux filiales : Adents Canada Inc et Adents US Inc.
«Grâce à cette levée de fonds, nous allons renforcer notre présence dans les principaux pays européens et nord-américains dans les prochains mois. Nous allons ainsi être en mesure de pouvoir répondre efficacement aux besoins de l’industrie pharmaceutique à l’approche des échéances réglementaires. Notre objectif est de devenir leader sur le marché de l’identification et de la traçabilité unitaire de produits pharmaceutiques.», explique Christophe Devins, PDG et co-fondateur d’Adents.
« Adents a développé une technologie unique et mature qui répond aux exigences de nouvelles règlementations. Elle est donc particulièrement bien positionnée pour devenir le leader d’un nouveau marché de plusieurs milliards d’euros.», ajoute Michel de Lempdes, Associé Gérant, Omnes capital.
Source : Adents
