Cancer : un test en ligne pour identifier ses risques en 3 minutes
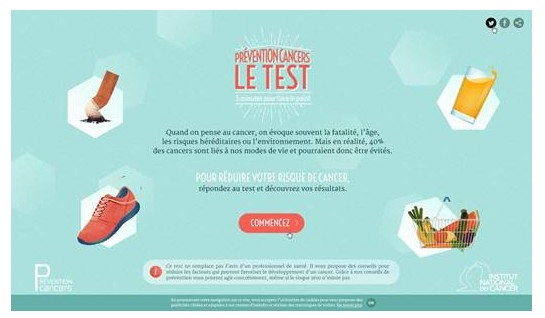 L’Institut national du cancer (INCa) a lancé mardi 23 juin une nouvelle campagne d’information sur le poids des principaux facteurs de risques du cancer en France. Pour aider chacun à identifier ses risques, l’INCa propose un test en ligne « Prévention cancers : le test, 3 minutes pour faire le point ».
L’Institut national du cancer (INCa) a lancé mardi 23 juin une nouvelle campagne d’information sur le poids des principaux facteurs de risques du cancer en France. Pour aider chacun à identifier ses risques, l’INCa propose un test en ligne « Prévention cancers : le test, 3 minutes pour faire le point ».
Le test se présente sous la forme d’un questionnaire court sur la consommation de tabac et d’alcool, les habitudes alimentaires et d’activité physique, l’exposition au soleil, l’âge et le poids. Il permet à chacun de connaître les facteurs de risque liés à son mode de vie et auxquels il est exposé et délivre des conseils sur mesure. L’internaute est systématiquement renvoyé vers des sources d’information et d’aide au changement de comportement sur le site de l’INCa (e-cancer.fr) ou sur les sites développés par l’INPES (mangerbouger.fr, tabacinfoservice.fr, alcool-info-service.fr). Le test permet également de faire prendre conscience des facteurs protecteurs face au cancer tels que la pratique d’une activité physique et le recours à une alimentation riche en fibres.
Afin de délivrer une information complète, le test propose également des contenus personnalisés sur les dépistages et sur d’autres facteurs de risque plus spécifiques (radon, traitements hormonaux de la ménopause) ou sur lesquels il est plus difficile d’agir (notamment les risques génétiques).
Enfin, le test s’accompagne de messages de précaution renvoyant vers le médecin traitant pour toute précision utile et rappelant que le risque zéro n’existe pas. A noter que le quizz est accessible sur smartphone et tablette.
Une campagne web pour clarifier les causes de cancer en France
Pour sensibiliser le grand public, une campagne sera diffusée du 23 juin au 15 juillet sur le web. Elle se compose de deux films interpellants qui présentent le poids prééminent de deux facteurs de risques : le tabac et l’alcool. Dans les deux spots, il est rappelé que 9 facteurs évitables sont à l’origine de près de 40 % des cancers.
Pour accéder à « Prévention cancers : le test, 3 minutes pour faire le point »
Source : INCa
