Etiquetage des médicaments : l’ANSM ne demande pas un « paquet neutre »
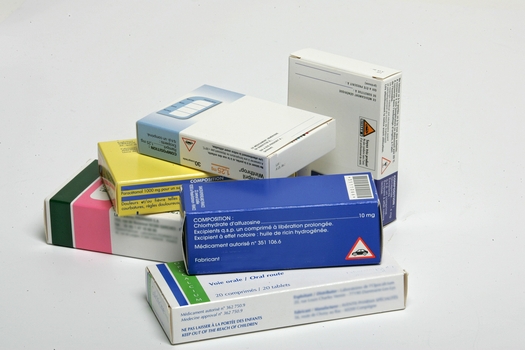 L’Agence nationale de sécurité du médicament (ANSM) vient de faire un point sur ses recommandations destinées aux industriels relatives aux noms et à l’étiquetage des médicaments délivrés avec ou sans ordonnance. L’agence rappelle notamment qu’elle ne souhaite en aucun cas la mise en place d’un « paquet neutre ».
L’Agence nationale de sécurité du médicament (ANSM) vient de faire un point sur ses recommandations destinées aux industriels relatives aux noms et à l’étiquetage des médicaments délivrés avec ou sans ordonnance. L’agence rappelle notamment qu’elle ne souhaite en aucun cas la mise en place d’un « paquet neutre ».
Publiées en février 2018, ces recommandations ont pour objectif de « faciliter l’identification du médicament et d’améliorer la visibilité, la lisibilité et la compréhension de son étiquetage, notamment des informations garantissant la sécurité des patients », souligne ainsi l’agence. Une démarche qui s’inscrit dans le plan initié par l’OMS pour réduire de moitié les erreurs médicamenteuses dans le monde. En effet l’OMS estime que ces dernières représentent au niveau mondial 1% des dépenses en santé.
Ces recommandations »n’ajoutent pas d’informations par rapport aux mentions existantes aujourd’hui sur les boîtes des médicaments, mais portent sur l’emplacement des mentions sur les différentes faces des boîtes, sur le choix de la police et de la taille d’écriture, sur les couleurs et sur l’apposition de pictogrammes », poursuit l’ANSM.
« Élaborées à l’appui de l’expérience des mesures déjà mises en œuvre et en concertation avec les représentants d’associations de patients et consommateurs, pharmaciens, médecins et industriels (Voir compte rendu et vidéos), les recommandations n’ont pas un caractère obligatoire, conformément aux dispositions européennes applicables en la matière », souligne-t-elle.
Elle précise que « toutefois, en vue de mieux informer les patients, les industriels sont invités à les suivre lors de la conception de leurs conditionnements en mettant en exergue la substance active, le dosage et d’autres informations comme notamment la voie d’administration, la population cible (par exemple adulte ou enfant), etc. sur la face principale de la boîte ».
« En aucun cas, l’ANSM souhaite la mise en place d’un « paquet neutre ». Les chartes graphiques et signes distinctifs, (couleurs, visuels) qui sont des éléments nécessaires à l’identification et au bon usage, ne disparaîtront pas des étiquetages », indique l’agence dans son point d’information.
« Les recommandations n’incitent pas à la suppression du nom de marque du médicament mais insistent sur le fait que la marque ne devrait pas apparaitre de façon prédominante par rapport aux mentions nécessaires pour le bon usage du médicament, car il est essentiel que les patients puissent identifier facilement ce que contient le médicament sans se fier uniquement à la marque », précise-t-elle.
Enfin, l’ANSM rappelle qu’elle est régulièrement destinataire de signalements d’erreurs médicamenteuses en lien avec le conditionnement ou le nom des médicaments, surdosage du fait d’une prise par le patient de deux médicaments avec la même substance active mais de marques différentes, surdosage lié à une confusion entre deux dosages d’un médicament, entre deux médicaments d’une même marque, prise d’un médicament mal conservé…
« L’étiquetage est le dernier support d’information avant l’étape d’administration. Il contribue, lorsqu’il est bien conçu, à la sécurité d’emploi du médicament et à la prévention des erreurs médicamenteuses notamment de dans le cadre de l’automédication », conclut l’agence.
A consulter sur le site de l’ANSM:
. Point d’information sur les conditionnements des médicaments
. Point d’information sur les noms de médicaments
. Commission mixte du 16 novembre 2017 : compte rendu et vidéos
Source et visuel : ANSM
