Genomic Vision étend son portefeuille de brevets avec le Code Morse génomique
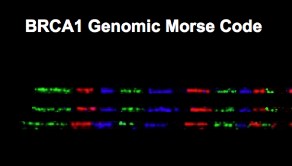 Genomic Vision, société de biotechnologie spécialisée dans le développement de tests de diagnostic génétiques par peignage moléculaire de l’ADN, a annoncé l’extension de son portefeuille de propriété intellectuelle, avec la délivrance dans plusieurs pays d’un brevet portant sur une méthode innovante d’analyse structurale et visuelle du génome, baptisée Code Morse Génomique (CMG).
Genomic Vision, société de biotechnologie spécialisée dans le développement de tests de diagnostic génétiques par peignage moléculaire de l’ADN, a annoncé l’extension de son portefeuille de propriété intellectuelle, avec la délivrance dans plusieurs pays d’un brevet portant sur une méthode innovante d’analyse structurale et visuelle du génome, baptisée Code Morse Génomique (CMG).
» Ce nouveau brevet s’inscrit dans la continuité d’un solide portefeuille de brevets couvrant le peignage moléculaire, dont Genomic Vision détient une licence mondiale exclusive. Avec le brevet Code Morse Génomique, le premier de ses propres brevets, Genomic Vision renforce son avantage concurrentiel et démontre sa force d’innovation », affirme Aaron Bensimon, PDG de Genomic Vision.
La technologie du peignage moléculaire permet la visualisation directe de grandes régions génomiques. Il devient ensuite possible d’identifier des anomalies génétiques en localisant des gènes ou séquences spécifiques dans le génome du patient par un marquage avec des balises. Ces balises, ou sondes moléculaires, sont visualisées par microscopie à fluorescence. En utilisant un nombre très limité de couleurs fluorescentes, les sondes sont conçues pour former des motifs, chacun spécifique d’un emplacement du génome, un peu à la manière du Code Morse traditionnel, d’où son appellation de Code Morse génomique.
Une technologie à haute résolution sur molécules d’ADN uniques
Le Code Morse Génomique est la clef qui ouvre la porte aux applications diagnostiques qui tirent avantage de cette technologie à haute résolution sur molécules d’ADN uniques. « Genomic Vision a développé cette stratégie pour la conception des sondes dans le souci de développer des tests diagnostiques qui offriraient une large couverture du génome tout en restant suffisamment simples pour être utilisables en pratique « , souligne ainsi le Dr Pierre Walrafen, chef de projet chez Genomic Vision et co-inventeur du GMC.
« La modularité et l’évolutivité du Code Morse Génomique permettront l’adaptation constante des tests diagnostiques aux nouvelles découvertes dans le domaine des grands réarrangements, qui ne fait que commencer à révéler son étendue et son importance en santé humaine », ajoute-t-il.
Huit familles de brevets
Dans la même optique, le portefeuille de brevet en propre ou en copropriété de Genomic Vision s’étend continuellement. Huit familles de brevets y ont été ajoutées jusqu’à présent. Ceux-ci couvrent les développements techniques, qu’ils ouvrent la voie à d’autres applications du peignage moléculaire ou qu’ils facilitent son utilisation comme outil de diagnostic. Ils couvrent également des biomarqueurs et des tests de diagnostic spécifiques qui impliquent des grands réarrangements du génome.
« Avec une recherche active dans ce domaine, un outil puissant qui apporte un point de vue unique et un réseau de collaborateurs experts, Genomic Vision bénéficie d’une position forte pour améliorer les approches existantes et effectuer de nouvelles découvertes », se réjouit son PDG, Aaron Bensimon. « De nouvelles opportunités, par exemple par échange de licences, surgiront du portefeuille biomarqueurs, qui seront un soutien fort pour le développement de Genomic Vision comme acteur global dans le domaine du diagnostic moléculaire
Source : Genomic Vision
