Gilead: données intérimaires de l’étude de Phase 2 LONESTAR
 Gilead Sciences vient d’annoncer qu’elle comptait initier un troisième essai clinique de Phase 3 de son comprimé combiné à dose fixe expérimental de sofosbuvir et de ledipasvir pour le traitement de l’infection par le virus de l’hépatite C chronique (VHC). Cette étude, appelée ION-3, évaluera la combinaison à dose fixe à prise unique quotidienne de sofosbuvir et de ledipasvir pendant 8 semaines avec et sans ribavirine (RBV) et pendant 12 semaines sans RBV chez 600 patients infectés par le VHC de génotype 1 non-cirrhotiques, naïfs de traitement.
Gilead Sciences vient d’annoncer qu’elle comptait initier un troisième essai clinique de Phase 3 de son comprimé combiné à dose fixe expérimental de sofosbuvir et de ledipasvir pour le traitement de l’infection par le virus de l’hépatite C chronique (VHC). Cette étude, appelée ION-3, évaluera la combinaison à dose fixe à prise unique quotidienne de sofosbuvir et de ledipasvir pendant 8 semaines avec et sans ribavirine (RBV) et pendant 12 semaines sans RBV chez 600 patients infectés par le VHC de génotype 1 non-cirrhotiques, naïfs de traitement.
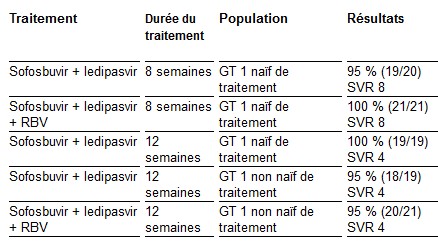
La conception d’ION-3 était basée sur les résultats intérimaires de l’étude de Phase 2 LONESTAR, qui a évalué 8 et 12 semaines de traitement utilisant la combinaison à dose fixe à prise unique quotidienne de sofosbuvir et de ledipasvir avec et sans RBV chez 60 patients non-cirrhotiques, naïfs de traitement.
Dans cette étude, 19/19 patients du bras de 12 semaines avaient atteint une réponse virologique soutenue quatre semaines après avoir complété le traitement (SVR4) et 40/41 des bras de huit semaines avaient atteint une réponse virologique soutenue huit semaines après avoir arrêté le traitement (SVR8), avec une rechute dans le bras recevant le sofosbuvir/ledipasvir sans RBV.
Deux autres cohortes de l’étude LONESTAR ont évalué un traitement de 12 semaines utilisant la combinaison à dose fixe de sofosbuvir et de ledipasvir avec ou sans RBV chez 40 patients qui n’avaient pas répondu précédemment à un traitement utilisant un schéma posologique basé sur des inhibiteurs de protéase spécifiques au VHC. La moitié de ces patients non naïfs de traitement sont atteints de cirrhose compensée, documentée. 95 % des patients des deux bras atteignirent SVR4, un patient cirrhotique du bras sofosbuvir et ledipasvir subit une rechute et un patient du bras sofosbuvir et ledipasvir plus RBV fut perdu de vue.
Les résultats intérimaires de LONESTAR sont résumés dans le tableau suivant. Des détails supplémentaires de cette étude seront présentés à une réunion scientifique future.
« Les résultats LONESTAR suggèrent qu’un traitement entièrement oral à prise unique quotidienne par l’inhibiteur nucléosidique de la protéine NS5B sofosbuvir et l’inhibiteur de la protéine NS5A ledipasvir a le potentiel de guérir la plupart des patients infectés par le VHC de génotype 1 avec une durée de traitement remarquablement courte », a déclaré Eric Lawitz, MD, président et directeur médical du Texas Liver Institute, University of Texas Health Science Center, à San Antonio, et investigateur principal de l’étude LONESTAR.
Le sofosbuvir en combinaison avec le ledipasvir, et le sofosbuvir en combinaison avec le ledipasvir et RBV étaient bien tolérés dans l’étude LONESTAR.
« Sur la base des résultats encourageants dérivés de LONESTAR, nous continuons à faire avancer notre recherche, évaluant de nouvelles combinaisons de médicaments et un traitement entièrement oral de plus courtes durées qui ont le potentiel de simplifier le traitement pour les personnes atteintes d’hépatite C », a commenté Norbert Bischofberger, PhD, vice-président directeur en recherche et développement et directeur scientifique chez Gilead Sciences.
Source : Gilead Sciences
