Immunothérapie en France: un constat mitigé selon une étude du Leem
 Poursuivant son exploration des thérapies du futur, le Leem publie aujourd’hui une étude sur l’immunothérapie : « Renforcer la filière de l’immunothérapie en France ». Cette étude, réalisée par le Comité Biotechnologies du Leem, dresse un tableau des atouts et des faiblesses de la France dans ce domaine.
Poursuivant son exploration des thérapies du futur, le Leem publie aujourd’hui une étude sur l’immunothérapie : « Renforcer la filière de l’immunothérapie en France ». Cette étude, réalisée par le Comité Biotechnologies du Leem, dresse un tableau des atouts et des faiblesses de la France dans ce domaine.
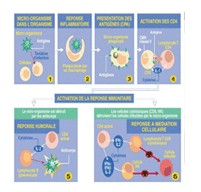
L’immunothérapie apparaît comme un fantastique vivier d’innovations thérapeutiques, dont l’exploitation commence à peine : les anticorps monoclonaux sont utilisés depuis une dizaine d’années seulement, deux vaccins thérapeutiques sont en essais cliniques de phase III. Avec les vaccins, les anticorps et les interférons, l’immunothérapie révolutionne la prise en charge des maladies infectieuses, de certains cancers « résistants » et de maladies auto-immunes invalidantes (sclérose en plaques, polyarthrite rhumatoïde, spondylarthrite ankylosante).
Les entreprises du médicament ont d’ailleurs largement investi ce champ de recherche : un tiers des médicaments en développement dans le monde sont des immunothérapies.
L’implantation de la filière de l’immunothérapie et de ses maillons en France – recherche académique, plateformes technologiques, biotechs, laboratoires pharmaceutiques – est donc stratégique pour la compétitivité industrielle française et bien sûr, en premier lieu, pour les malades.
L’immunothérapie est un champ thérapeutique en pleine évolution qui utilise des outils de plus en plus sophistiqués (approches technologiques) : fragments d’anticorps couplés à des radioéléments, à des récepteurs, à des peptides… Sur 65 approches technologiques prometteuses à l’horizon 2025, l’étude en a identifié 15 dans lesquelles la France pourrait jouer un rôle : 2 en immunothérapies cellulaires, 5 dans les vaccins, 4 dans les anticorps et 2 dans les immunomodulateurs.
Cependant, le constat de l’étude est mitigé : si la France est actuellement leader dans certains domaines (vaccins, désensibilisation), sa présence s’effrite en termes de développement clinique et d’implantation biotechnologique.
C’est pourquoi, ainsi que l’ont souligné, Jean-Paul Soulillou, Professeur d’immunologie, Université de Nantes – Pierre-Yves Bonnefoy, Vice-Président Recherche et Développement, Transgène – Alain Beck, Directeur Physico-chimie des anticorps, Pierre Fabre – Abderrahim Oukessou, Directeur médical Oncologie, Bristol-Myers Squibb : « il est urgent de capitaliser sur notre expertise en vaccinologie, de fixer la bioproduction innovante en France et d’investir dans des plateformes techniques collaboratives ». Faute de quoi, nous ne ferons que de la figuration dans ce champ thérapeutique en devenir.
L’intégralité de l’étude « Renforcer la filière de l’immunothérapie en France »
Source : Leem
