Maladie de Crohn : une économie de plus de 130 millions d’euros en France grâce au monitoring des biothérapies
 Theradiag, société spécialisée dans le diagnostic in vitro et le théranostic, a annoncé les résultats d’une étude pharmaco-économique qui démontre que l’utilisation du dosage d’anti-TNF et d’anticorps anti-médicaments dans la prise en charge des patients atteints de la maladie de Crohn et traités par biothérapie, permet jusqu’à 25% d’économies du coût des traitements, soit 131 millions d’euros sur 5 ans en France uniquement.
Theradiag, société spécialisée dans le diagnostic in vitro et le théranostic, a annoncé les résultats d’une étude pharmaco-économique qui démontre que l’utilisation du dosage d’anti-TNF et d’anticorps anti-médicaments dans la prise en charge des patients atteints de la maladie de Crohn et traités par biothérapie, permet jusqu’à 25% d’économies du coût des traitements, soit 131 millions d’euros sur 5 ans en France uniquement.
Selon Michel Finance, Directeur Général de Theradiag, « les résultats de cette étude pharmaco-économique renforcent la valeur des tests de théranostic de Theradiag . « Les maladies auto-immunes représentent un important enjeu de santé publique et le coût d’utilisation des biothérapies pour la sécurité sociale est lourd, particulièrement pour les patients en perte de réponse. Les résultats de cette étude démontrent l’intérêt médico-économique de l’utilisation d’un test de monitoring dans le suivi des patients et de la prise en charge thérapeutique personnalisée. En répondant pleinement à ces besoins, nos tests de théranostic Lisa Tracker représentent un potentiel important pour mieux contrôler l’efficacité des biothérapies et pour réaliser des économies supérieures à 130 millions d’euros. »
Les anti-TNF : des biothérapies largement prescrites avec une efficacité démontrée mais se révélant souvent inadaptées et coûteuses
Les maladies avec dérégulation du système immunitaire telles que la polyarthrite rhumatoïde, la spondylarthrite ankylosante ou les maladies inflammatoires chroniques de l’intestin (MICI) sont des pathologies chroniques qui affectent plus de 28 millions de personnes dans le monde. Les biothérapies, qui utilisent des molécules du vivant comme traitement, entraînent souvent des réactions de défense de l’organisme, rendant les médicaments inefficaces. Or, elles représentent 70% des nouveaux médicaments, d’où la nécessité de les monitorer pour permettre au clinicien d’évaluer la réponse du patient afin d’anticiper, d’optimiser et de ré-orienter le traitement.
« Compte tenu de l’utilisation de plus en plus fréquente des traitements par anti-TNF (en France, environ 85 000 patients dont 30 000 patients souffrant de MICI), de leur coût (de 14 000 à 16 000 euros par an et par patient) et de la sévérité des pathologies concernées, il apparaît indispensable de rationaliser leur prescription pour mieux contrôler leur efficacité et leur tolérance », souligne la société dans son communiqué.
L’étude a porté sur une double cohorte de patients (3 000 et 10 000) atteints de la maladie de Crohn, traités par anti-TNFα et sur une période donnée (1, 3 et 5 ans). Elle a été menée par le Pr Duru (Directeur de Recherche Honoraire au CNRS) et le Pr Lamure (Professeur, Université Claude Bernard, Lyon), responsables du modèle, et par 3 experts gastro-entérologues, le Dr Attar (Hopital Beaujon, Clichy), le Pr Peyrin-Biroulet (CHU, Nancy) et le Pr Roblin (CHU, Saint-Etienne). Les paramètres du modèle sont issus de la littérature, d’hypothèses et de calculs actuariels.
L’étude a permis de déterminer d’une part, l’estimation des coûts de traitement par anti-TNF pour chacune des 2 cohortes sur les périodes d’une année, de trois années et de cinq années et d’autre part, l’impact sur ces coûts de l’introduction d’un test biologique permettant d’optimiser l’utilisation de biomédicaments. Les résultats de l’analyse confirment que l’incidence financière de l’utilisation du dosage sur le budget de santé est très importante : jusqu’à 22% d’économies à 3 ans et 25% à 5 ans et ce, pour les seuls patients atteints de la maladie de Crohn et traités par biothérapie.
Les économies, pour les cohortes de 3 000 et 10 000 patients, sont présentées dans les tableaux suivants :
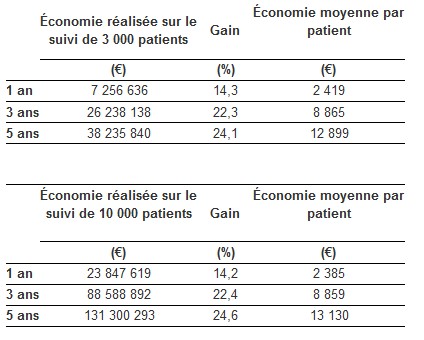
Le Pr Roblin présentera ces résultats au Congrès international de Gastroentérologie, United European Gastroenterology Week, se tenant à Vienne (Autriche) du 18 au 22 octobre 2014.
« Si cette étude était extrapolée à l’ensemble des pays utilisant ces biothérapies dans la maladie de Crohn ainsi qu’aux malades atteints d’autres pathologies auto-immunes et traités par biothérapie, les économies pour les systèmes de santé se chiffreraient à des centaines de millions d’euros », indique enfin Theradiag.
Source : Theradiag
