Médicaments : l’AFIPA dénonce la mesure du « paquet neutre »
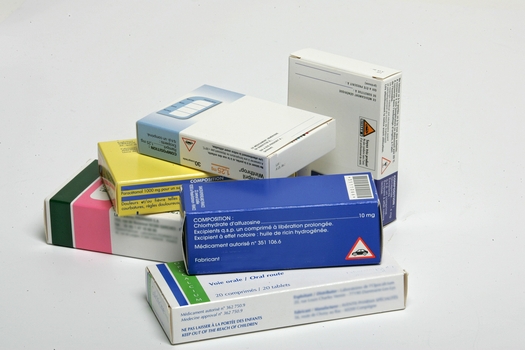 L’Afipa (Association française de l’industrie pharmaceutique pour une automédication responsable) a réagi jeudi 31 mai suite à la publication en février dernier par l’Agence nationale de sécurité du médicament (ANSM) d’une recommandation visant à standardiser les conditionnements de certains médicaments. L’Association met en garde contre une mesure « source de confusion pour les patients ».
L’Afipa (Association française de l’industrie pharmaceutique pour une automédication responsable) a réagi jeudi 31 mai suite à la publication en février dernier par l’Agence nationale de sécurité du médicament (ANSM) d’une recommandation visant à standardiser les conditionnements de certains médicaments. L’Association met en garde contre une mesure « source de confusion pour les patients ».
La recommandation publiée par l’ANSM invite à faire figurer sur certains packs de médicaments la dénomination commune des principes actifs dans une police de taille supérieure à celle des autres mentions, y compris à la taille utilisée pour le nom de fantaisie ou du laboratoire. Ce texte recommande également l’occultation de certains signes distinctifs tels que le logo de marque, et favorise la démultiplication des informations. Cette recommandation à l’attention des demandeurs et titulaires d’autorisations de mise sur le marché et d’enregistrements concerne l’étiquetage des conditionnements des médicaments sous forme orale solide (hors homéopathie).
« Cette recommandation va avoir un très fort impact sur les conditionnements de médicaments d’automédication en rendant moins visible le nom de marque au profit de la dénomination commune des substances actives », estime notamment l’Afipa dans un communiqué. « En effet, les exemples de mise en application réalisés par plusieurs laboratoires pharmaceutiques font clairement prendre conscience de la moindre lisibilité et de la ressemblance entre les packs qui en résulteraient », poursuit-elle.
Selon l’association, « la marque favorise ainsi la mémorisation et l’identification par le patient du médicament dont il a l’habitude et constitue un facteur de sécurisation de l’automédication, la dénomination des actifs se révélant souvent complexe ». L’Afipa entend ainsi attirer l’attention de l’ANSM et du Ministère de la santé sur « les risques de confusion entre les différents conditionnements de médicaments découlant de cette nouvelle mesure ».
L’Afipa indique demander le retrait de cette « recommandation aux conséquences potentielles dramatiques, afin de pouvoir retravailler ce projet en réelle coopération et de façon constructive avec les autorités ». Un recours en annulation a été déposé au Conseil d’Etat fin avril par l’Association.
Consulter les recommandations sur le site de l’ANSM
Source : Afipa
