Mucoviscidose : Mukk, la 1ère application pour accompagner les patients dans leur quotidien
 Réalisée conjointement par l’association Vaincre la Mucoviscidose et Novartis, pour les patients et leurs proches, l’application Mukk a pour objectif d’accompagner et de faciliter le quotidien des patients atteints de mucoviscidose. En France, plus de 7 000 personnes sont atteintes de cette maladie et 2 millions de personnes sont porteuses saines du gène à l’origine de la mucoviscidose.
Réalisée conjointement par l’association Vaincre la Mucoviscidose et Novartis, pour les patients et leurs proches, l’application Mukk a pour objectif d’accompagner et de faciliter le quotidien des patients atteints de mucoviscidose. En France, plus de 7 000 personnes sont atteintes de cette maladie et 2 millions de personnes sont porteuses saines du gène à l’origine de la mucoviscidose.
Maladie génétique invisible et non contagieuse, la mucoviscidose est une se caractérise par la sécrétion d’un mucus épais et visqueux au niveau de plusieurs organes, principalement les poumons et le pancréas, expliquant les atteintes respiratoires (obstruction des bronches et infections) et les troubles digestifs (mauvaise absorption des graisses et troubles nutritionnels).
La mucoviscidose entrave considérablement la vie des patients qui sont soumis à un suivi médical régulier et des règles d’hygiène importantes. Leurs journées sont rythmées par la prise de médicaments, les séances de kinésithérapie et d’aérosols, les rendez-vous et les examens médicaux.
La complexité des soins rend souvent les actes de la vie quotidienne difficiles et impacte tous les domaines de la vie familiale, scolaire, ou professionnelle. Dès lors, pouvoir bénéficier d’une application adaptée aux contraintes de la maladie était un besoin identifié par les patients et leurs proches.
L’application Mukk possède plusieurs fonctionnalités de suivi :
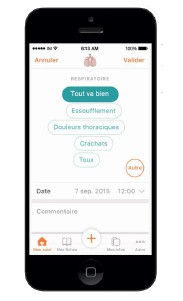
– La saisie régulière d’indicateurs de santé permet au patient de définir au quotidien son état général (douleur, respiration, digestif, glycémie…) et de le commenter. Ces données peuvent être alors imprimées pour une visite chez le médecin, de manière à lui présenter un historique sur plusieurs jours, semaines, ou mois selon son besoin.
– Un agenda des soins et des rendez-vous avec les professionnels de santé et d’accompagnement pour n’en oublier aucun.
– Un espace personnel de stockage d’informations (contacts, ordonnances, résultats d’examens…) pour une organisation optimale.
– Une mise à disposition de fiches pratiques sur la maladie, les soins, le voyage ou encore la vie scolaire ou professionnelle. Toutes ces fiches peuvent être partagées par email. Il est également possible de créer ses propres fiches.
Mukk est un véritable outil d’accompagnement du patient dans son quotidien, disponible gratuitement sur iOS et Android. Il n’a pas vocation à se substituer à quelque avis ou suivi médical que ce soit.
Pour plus d’informations : www.vaincrelamuco.org
Source et visuel : Novartis
