Transgene lance myvac™ , une immunothérapie individualisée contre les tumeurs solides
 Transgene, société de biotechnologie qui conçoit et développe des immunothérapies contre les cancers et les maladies infectieuses, lance myvac™ , une immunothérapie individualisée contre le cancer reposant sur un vecteur viral, qui entrera en clinique dès 2019.
Transgene, société de biotechnologie qui conçoit et développe des immunothérapies contre les cancers et les maladies infectieuses, lance myvac™ , une immunothérapie individualisée contre le cancer reposant sur un vecteur viral, qui entrera en clinique dès 2019.
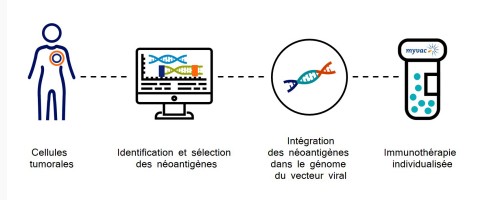
myvac™ est une immunothérapie conçue pour stimuler et éduquer le système immunitaire des patients afin de reconnaître et détruire les cellules tumorales. Cette immunothérapie personnalisée est conçue pour chaque patient, sur la base des mutations identifiées dans sa tumeur. Ces mutations constituent des cibles particulièrement pertinentes puisqu’elles conduisent à l’expression de néoantigènes tumoraux. Ces néoantigènes sont connus pour susciter une réponse immunitaire plus forte que les antigènes tumoraux « classiques »2 et sont la pierre angulaire de la réponse antitumorale.
Une fois identifiés par séquençage et sélectionnés en utilisant des algorithmes d’intelligence artificielle, plusieurs néoantigènes sont intégrés dans le génome du vecteur viral (MVA) ; ainsi, lorsque myvac™ est administré au patient, il déclenche une cascade immunitaire contre un éventail de cibles présentes dans les cellules cancéreuses.
Cette approche diffère des traitements autologues puisqu’aucun matériel biologique du patient n’est utilisé dans la fabrication de cette immunothérapie, la rendant plus facile à fabriquer. Elle est aussi véritablement individualisée, car nous utilisons l’information propre aux caractéristiques de sa tumeur. Pour créer ce traitement prometteur, Transgene a associé son savoir-faire en matière de vecteurs viraux avec des technologies particulièrement innovantes.
myvac™ dispose de plusieurs atouts clés :
. Les avantages d’un traitement individualisé sans les inconvénients liés à la production des approches autologues (Transgene ne modifie pas les cellules du patient, mais intègre le panel de néoantigènes dans son virus) ;
. Une souche virale (MVA) dont la sécurité, la tolérance, l’immunogénicité et l’efficacité ont été démontrées par les essais cliniques déjà conduits pour TG4010 et TG4001 ;
. Le vecteur viral de myvacTM (MVA) a montré à plusieurs reprises qu’il induit une réponse immunitaire contre des antigènes tumoraux intégrés dans son génome. De plus, par sa nature virale et le ciblage de cibles multiples, il induit un élargissement du répertoire immunitaire antitumoral (epitope spreading) ;
. Une formule « tout-en-un », ne nécessitant ni adjuvant ni association de différents peptides.
Éric Quéméneur, PhD, Directeur Général Adjoint, Directeur Recherche et Développement de Transgene, explique : « Avec myvac™, Transgene est à la pointe de l’innovation en matière d’immunothérapie contre le cancer. En nous appuyant sur notre savoir-faire en virothérapie, nous avons réussi l’intégration des séquences codant pour des néoantigènes dans notre immunothérapie individualisée. En intégrant le séquençage et l’intelligence artificielle dans la conception du virus, myvac™ marque l’entrée des approches basées sur des vecteurs viraux dans l’ère de la transformation numérique. Nous avons mis en place une organisation capable de concevoir et fabriquer ce produit individualisé pour chaque patient dans des conditions de temps et de coûts très compétitives. Cette innovation est une évolution logique de nos expertises. Cette nouvelle option thérapeutique est la promesse d’une amélioration majeure par rapport aux thérapies existantes. myvacTM est aussi le résultat de notre politique d’ouverture vers des partenaires développant des technologies complémentaires de nos expertises, pour développer une approche pluridisciplinaire. Nous avons hâte de démontrer chez l’homme le potentiel transformant de myvac™ grâce aux essais cliniques qui démarreront en 2019. »
myvac™, un projet ambitieux qui entrera en clinique en 2019
myvac™ sera administré à des patients ayant des tumeurs solides. Deux essais cliniques sont en cours de préparation en Europe et aux États-Unis, notamment dans les cancers de la tête et du cou HPV-négatifs et dans le cancer de l’ovaire, pour un démarrage courant 2019. Les premiers résultats précliniques et translationnels seront présentés prochainement à des congrès d’immuno-oncologie.
Un réseau innovant qui combine bio-ingénierie et transformation numérique
Pour concevoir myvac™, Transgene et son réseau collaboratif ont relevé plusieurs défis scientifiques et techniques. Ils forment un réseau dont les expertises couvrent l’ensemble des métiers requis :
. L’Institut Curie (Centre d’Immunothérapie des Cancers, dirigé par le Pr Amigorena) intervient sur la génération de données translationnelles et la caractérisation du mécanisme d’action ;
. HalioDx étudie les biomarqueurs permettant de maximiser l’efficacité de la thérapie ;
. Traaser automatise, sécurise et gère les données génomiques, en intégrant notamment des algorithmes prédictifs fournis par un partenaire reconnu en intelligence artificielle ;
Transgene a mis au point une unité pilote de fabrication unique en France permettant de vectoriser les néoantigènes et de mettre à disposition myvacTM dans des délais compatibles avec la prise en charge clinique. Ce projet innovant a obtenu la labellisation de BioValley France, pôle de compétitivité santé du Grand Est, et d’Eurobiomed. Transgene détient la propriété intellectuelle de la plateforme virale myvac™, et travaille activement au développement translationnel de cette technologie innovante.
[1] Néoantigènes tumoraux : mutations génétiques des cellules tumorales propres au patient. Contrairement aux antigènes tumoraux « classiques » qui signent l’identité d’un type de tumeur, les néoantigènes sont uniques.
[2] Chen DS, Mellman I., Elements of cancer immunity and the cancer-immune set point, Nature (2017) 541:321–30.10.1038/nature21349
Source : Transgene
