Autotests VIH : Mylan et AAZ font le bilan un an après le lancement
 Le 15 septembre 2015, le premier autotest de dépistage du VIH, fabriqué par la société française AAZ et distribué par le laboratoire Mylan était mis à disposition du grand public dans les officines sans prescription médicale. Un an après leur lancement, près de 2 000 autotests VIH sont achetés en moyenne chaque semaine en France.
Le 15 septembre 2015, le premier autotest de dépistage du VIH, fabriqué par la société française AAZ et distribué par le laboratoire Mylan était mis à disposition du grand public dans les officines sans prescription médicale. Un an après leur lancement, près de 2 000 autotests VIH sont achetés en moyenne chaque semaine en France.
Mylan et AAZ indiquent dans un communiqué commun que près de 140 000 autotests(1) ont été ainsi référencés par plus de 11 200 pharmacies(1) (soit un peu plus d’1 pharmacie sur 2 en France) au cours des 12 derniers mois.
Selon la Société Française de Lutte contre le Sida, plus de 80% des pharmaciens interrogés qui sont dans cette démarche ont suivi une formation aux autotests(2). A ce jour, plus de 4 000 pharmacies ont installé le kit de sensibilisation au dépistage du VIH dans leur officine. Ce kit contient un guide d’information destiné à toute l’équipe officinale ainsi que des outils de communication en vitrine et au comptoir pour sensibiliser le grand public au dépistage.
Dépistage : le rôle majeur des autorités de santé
Selon les deux sociétés, les actions de communication à l’initiative du Ministère de la Santé (3) (annonce de la mise à disposition d’autotest VIH® en pharmacie) et la campagne d’incitation au dépistage de l’INPES (4) de décembre 2015 ont facilité l’accès à l’information et ont permis d’intégrer autotest VIH® parmi les moyens déjà disponibles de dépistage.
Par ailleurs, les outils d’aide à la réalisation du test ont été fortement utilisés. Plus de 22 000 visionnages des vidéos de démonstration de l’autotest ont été réalisés. Plus de 3 000 demandes d’informations sur l’autotest ont été enregistrées sur le numéro vert de Sida Info Service(5), 3% d’entre elles concernaient un accompagnement à la réalisation d’autotest VIH®.
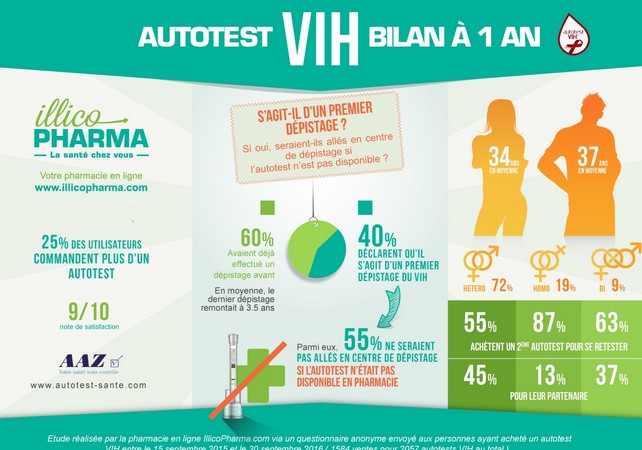
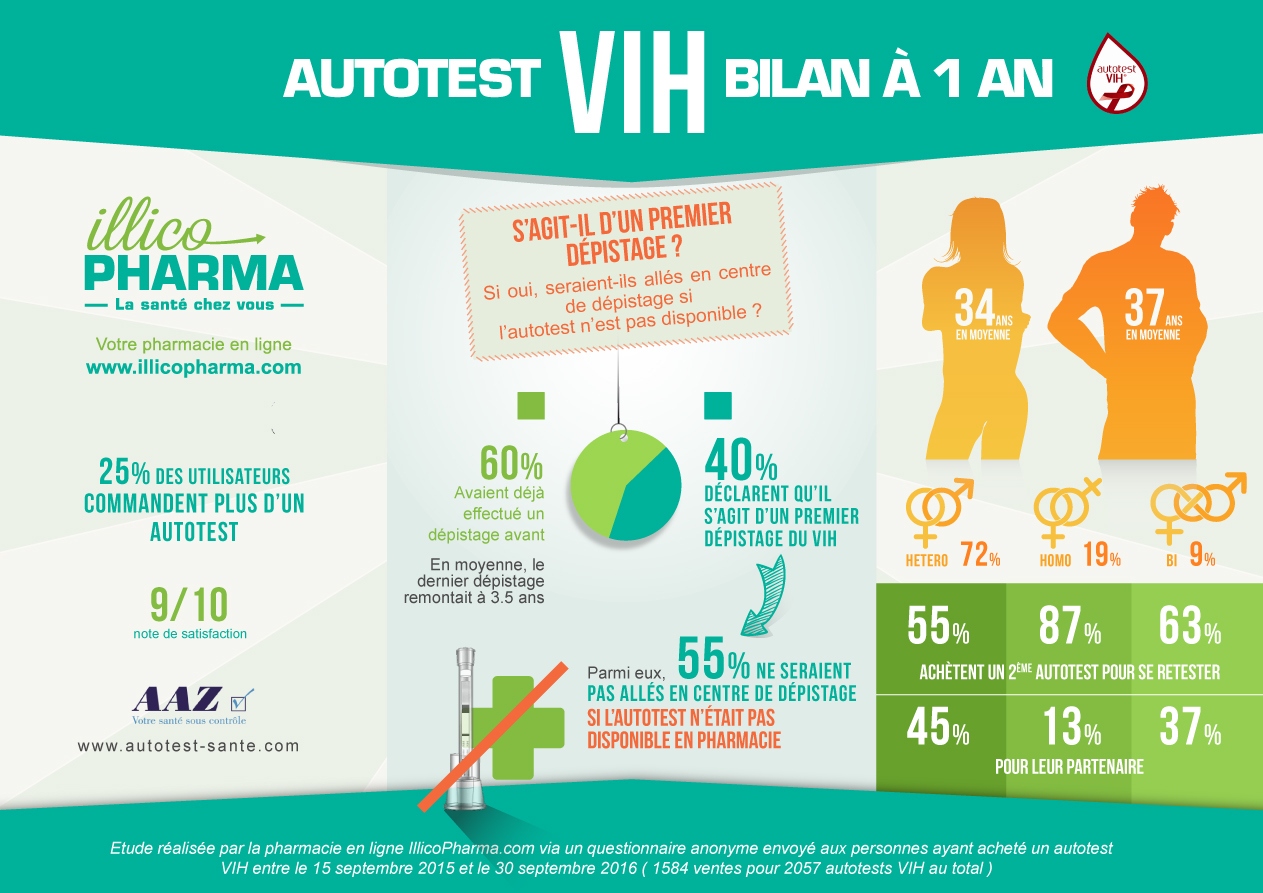
Une enquête menée par IllicoPharma(6) depuis le lancement en septembre 2015 sur ses ventes, montre que l’autotest touche une population qui ne se serait pas dépistée autrement. En effet, pour 40% des utilisateurs, il s’agissait d’un premier dépistage du VIH. Parmi eux, 55% déclarent qu’ils ne seraient pas allés dans un centre de dépistage si l’autotest n’avait pas été disponible en pharmacie. Lors de l’achat sur internet, 25 % d’entre eux achètent 2 autotests ou plus pour se re-tester eux-mêmes ou pour leur partenaire(6).
Si l’impact en matière de découvertes de nouvelles séropositivités via autotest VIH® est encore difficile à évaluer précisément, celui-ci sera quantifiable dès l’année prochaine puisque la déclaration obligatoire de l’infection au VIH et du SIDA qui est renseignée par le professionnel de santé inclut désormais l’autotest parmi les moyens de dépistage. Néanmoins, de nombreux centres de dépistage et services de maladies infectieuses ont déjà rapporté avoir pris en charge des patients s’étant présentés suite à un autotest VIH® présentant un résultat positif(7).
(1) Données internes Mylan au 30/09/2016
(2) SFLS – Enquête sur la dispensation des autotests VIH en France (septembre 2015-avril 2016), publiée en juillet 2016
(3) http://social-sante.gouv.fr/IMG/pdf/140915_-_cp_-_autotests_vih.pdf
(4) http://inpes.santepubliquefrance.fr/30000/actus2015/063-journee_mondiale_lutte_contre_sida.asp
(5) Données internes Sida info service au 31 août 2016
(6) Illicopharma – Pharmacie en ligne – Enquête menée sur 2057 autotests vendus du 15 septembre 2015 au 30 septembre 2016
(7) Source interne AAZ
Source /infographie : AAZ / Mylan
