Boehringer Ingelheim France lance la page Facebook « La BPCO et moi »
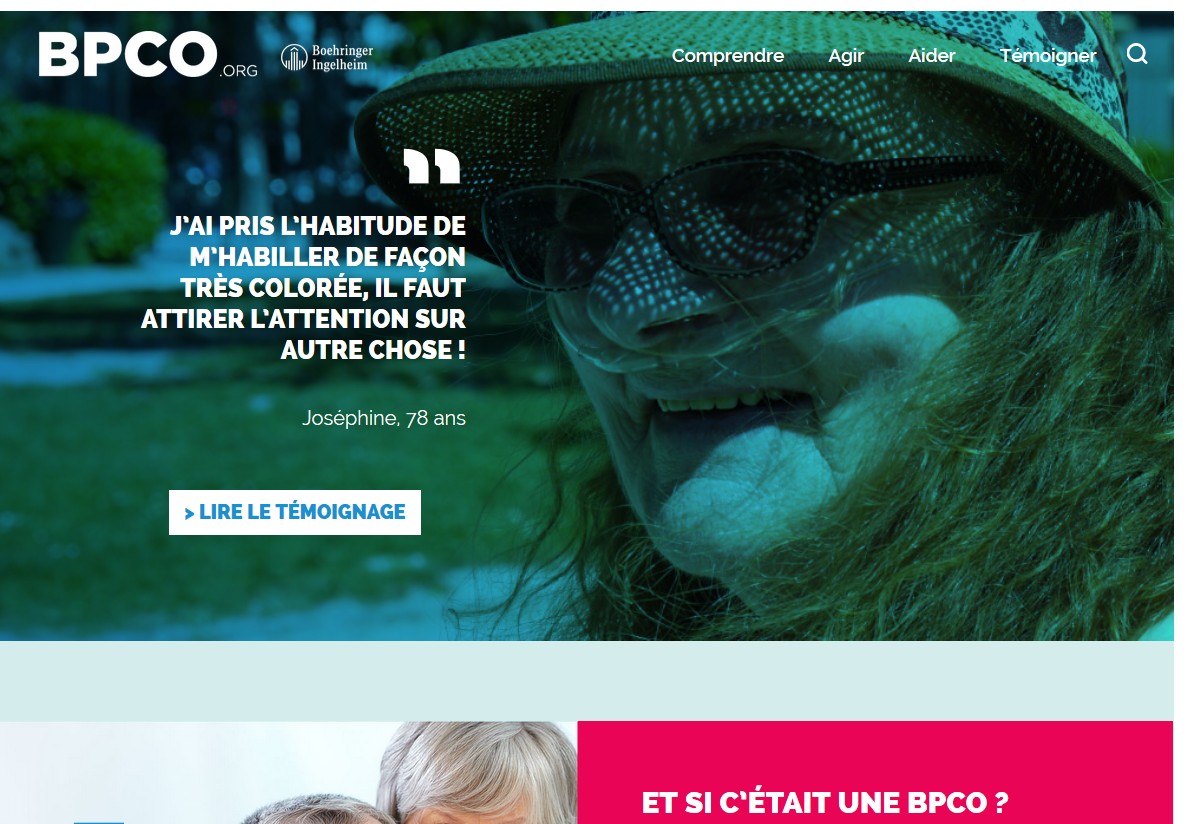 Pour faire suite à la création d’un site web à destination des personnes atteints de Broncho-Pneumopathie Chronique Obstructive (BPCO), Boehringer Ingelheim France lance la première page Facebook à leur usage, dans l’objectif constant de faciliter l’accès des malades aux informations.
Pour faire suite à la création d’un site web à destination des personnes atteints de Broncho-Pneumopathie Chronique Obstructive (BPCO), Boehringer Ingelheim France lance la première page Facebook à leur usage, dans l’objectif constant de faciliter l’accès des malades aux informations.
Boehringer Ingelheim France a d’abord lancé, en 2011, BPCO.org, le premier site spécialisé dans cette maladie. L’objectif était alors affirmé : mettre à disposition du grand public de l’information de qualité, validé par un comité scientifique et ainsi pouvoir répondre au besoin d’information des patients, qui n’ont pas toujours suffisamment de temps pour échanger avec leur praticien lors des consultations. Ce site a remporté un grand succès, et sa rubrique « témoignages » est la plus diffusée sur les réseaux sociaux (760 partages sur Facebook depuis sa création en septembre 2017).
Cet enthousiasme de la part des patients a conforté Boehringer Ingelheim France dans sa volonté de dédier une page Facebook à la BPCO. « Nous avons constaté que les patients ressentent le besoin de partager des informations avec leur entourage via ce réseau social, et pourtant, il n’existe aucun outil directement lié à la BPCO sur Facebook », analyse Anne-Rachel Unger, Responsable Communication chez Boehringer Ingelheim France. « La limitation de l’inactivité fait que la BPCO peut être mal perçue par l’entourage : nous souhaitons au travers de cette page Facebook motiver et entraîner les patients dans une dynamique positive autour de leur maladie. Leur redonner l’envie de rester actifs », indique-t-elle. Et de détailler : « Il y aura une tonalité positive, de l’information, des témoignages, des campagnes encourageant à la reprise et/ou la poursuite d’une activité physique adaptée, des conseils pour gérer le quotidien. »
Facebook : un outil au service des patients
« Facebook apparaît de plus en plus comme un outil utile pour les patients », indique David Réguer, spécialiste du marketing digital et fondateur de l’agence RCA, avant de préciser : « Les réseaux sociaux modifient le rapport des patients et leur maladie. Les formes d’expression et de mobilisation évoluent, Facebook permet par exemple de trouver de nouveaux espaces d’échanges, d’expériences et le partage de connaissance ». C’est d’ailleurs ce que confirme une enquête Vidal France*, qui indique que 85 % des médecins généralistes et 83 % des médecins spécialistes pensent que les échanges et les informations partagés sur les réseaux sociaux sont efficaces.
Et Anne-Rachel Unger de conclure : « Avec notre page Au coeur de l’AVC (plus de 58 000 fans), nous avons l’expérience de ce que les réseaux sociaux apportent aux personnes victimes ou souffrants d’une maladie et à leur proches : un espace de communication entre patients, du soutien dans le quotidien. Notre volonté est de leur apporter ce même soutien en matière de BPCO ».
La BPCO touche 210 millions de personnes à travers le monde, et devrait devenir la troisième cause de mortalité d’ici 2030. En France, 3,5 millions de personnes souffriraient de BPCO. Cette maladie progressive réduit la capacité respiratoire et affecte les activités quotidiennes. Une situation qui peut entraîner un cercle vicieux menant vers une aggravation des symptômes et une accentuation de l’inactivité, contribuant à une augmentation du risque d’incapacité et de mortalité.
* Enquête VidalFrance, le Pôle Pharmacie-Santé des Echos Etudes et Méditailing, avril 2015
http://www.vidalfrance.com/wpcontent/download/Industrie/Filrouge2_avril2015/Les_Echos_Etudes_VIDAL_Medecins%20connectes_avril%202015.pdf (Dernier accès en janvier 2018).
Source et visuel : Boehringer Ingelheim

