Essais cliniques: France Biotech alerte sur la dégradation de l’attractivité de la France
 France Biotech, l’association des entrepreneurs en biotechnologie et sciences de la vie alerte le gouvernement sur la dégradation de l’attractivité de la France en matière d’essais cliniques. Selon les données de la « EU Clinical Trials Register », le registre européen des essais cliniques sur de nouveaux médicaments, la France est aujourd’hui dépassée par la plupart des autres grands pays européens.
France Biotech, l’association des entrepreneurs en biotechnologie et sciences de la vie alerte le gouvernement sur la dégradation de l’attractivité de la France en matière d’essais cliniques. Selon les données de la « EU Clinical Trials Register », le registre européen des essais cliniques sur de nouveaux médicaments, la France est aujourd’hui dépassée par la plupart des autres grands pays européens.
« La place de la France, en queue de peloton pour le nombre d’essais cliniques de nouveaux médicaments, loin derrière l’Allemagne, le Royaume-Uni et même la Belgique, est un constat inquiétant, » affirme Maryvonne Hiance, Présidente de France Biotech.
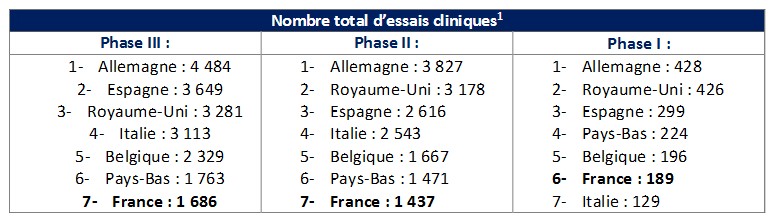
« Ce décrochage français s’explique par l’existence de freins réglementaires à l’innovation dans les domaines du médicament et des dispositifs médicaux, et également par une évaluation inadéquate du bénéfice-risque (le risque zéro n’existant pas en recherche) », estime l’association dans un communiqué.
« Le retard français en matière d’essais cliniques se traduit par un accès retardé aux nouveaux traitements en cours d’investigation clinique pour les patients, par une incitation à la délocalisation des entreprises innovantes et par une moindre visibilité des médecins et chirurgiens français qui ne seront pas aussi souvent signataires de publications que leurs confrères internationaux, » souligne Maryvonne Hiance.
La dégradation de l’attractivité française a également des répercussions économiques pour les établissements hospitaliers de l’Hexagone. « Pour un essai clinique, les entreprises innovantes de la santé financent un hôpital ou une clinique environ 15 000 Euros par patient. Sur la base du différentiel avec le Royaume Uni, où sont réalisés aujourd’hui deux fois plus d’essais cliniques qu’en France, et avec une moyenne de 50 patients par expérimentation, le manque à gagner pour les hôpitaux et cliniques français approche les 2 milliards d’Euros ! », détaille Maryvonne Hiance.
L’association rappelle enfin que le 13 juillet 2016 dans une lettre ouverte adressée à Marisol Touraine, la ministre des Affaires Sociales, de la santé et des droits des femmes, elle s’inquiétait de l’encadrement juridique en France des essais cliniques et notamment de la « désignation aléatoire » des comités chargés d’émettre un avis sur les protocoles de recherche.
1- EU Clinical Trials Register [consulté le 13 février 2017] https://www.clinicaltrialsregister.eu/
Source : France Biotech
