Genticel : résultats complémentaires à 12 mois de phase 2 de GTL001 contre les infections HPV 16 et 18
 Genticel, société française de biotechnologie, qui développe des immunothérapies innovantes pour prévenir les cancers induits par le virus du papillome humain (HPV), vient d’annoncer des résultats complémentaires à 12 mois de l’étude de phase 2 de GTL001, son candidat immunothérapeutique contre les infections HPV 16 et 18.
Genticel, société française de biotechnologie, qui développe des immunothérapies innovantes pour prévenir les cancers induits par le virus du papillome humain (HPV), vient d’annoncer des résultats complémentaires à 12 mois de l’étude de phase 2 de GTL001, son candidat immunothérapeutique contre les infections HPV 16 et 18.
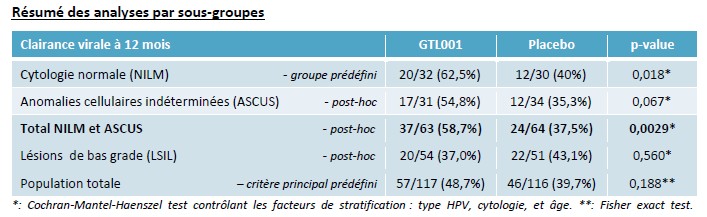
Les résultats préliminaires à 12 mois de l’étude de phase 2 de GTL001, annoncés le 27 janvier 2016, ont montré une séparation statistique (p=0,018) dans le sous-groupe prédéfini des patientes avec cytologie normale (NILM), qui représente environ 75% de la population cible de GTL001. En complément, l’analyse post-hoc indique une tendance vers la significativité statistique dans le sous-groupe des femmes présentant des anomalies cellulaires indéterminées (ASCUS).
De ce fait, le regroupement post-hoc des patientes avec cytologie normale (NILM) et des patientes avec anomalies cellulaires indéterminées (ASCUS) fait lui aussi apparaitre une séparation statistiquement significative (p= 0,0029). L’ensemble de ces patientes, qui ne présentent pas encore de lésions de bas grade (LSIL), constitue la très large majorité (plus de 80%) des femmes infectées par HPV que GTL001 entend traiter.
« Ces données complémentaires très encourageantes sont indicatives du potentiel de GTL001 à apporter une solution thérapeutique aux femmes infectées par les deux types les plus dangereux d’HPV, avant l’apparition de lésions. Ces tendances devront être confirmées par les données à 18 puis 24 mois, mais ces observations sont extrêmement encourageantes et valident l’activité biologique de GTL001 chez les sujets porteurs de HPV 16 et / ou 18, avant l’apparition de lésions de bas grade, » déclare Benedikt Timmerman, PhD., MBA, président du directoire de Genticel.
« De plus, les résultats de cette étude de phase 2 nous permettront de préciser les modalités de la suite du programme de développement clinique de GTL001. Nous attendons avec confiance le terme de cette étude à 24 mois, prévu au 1er trimestre 2017. », poursuit-il.
Source : Genticel
