L’ANSM suspend les AMM de 11 spécialités commercialisées en France
 L’ANSM a décidé, dans l’attente de l’issue de la procédure d’arbitrage européen, de suspendre les Autorisations de Mise sur le Marché (AMM) de 11 spécialités en raison de « sérieuses réserves sur l’intégrité des données issues des essais de bioéquivalence menés sur les deux sites indiens (Chennai et Coimbatore) du centre de recherche Micro Therapeutic Research (MTR) Labs ».
L’ANSM a décidé, dans l’attente de l’issue de la procédure d’arbitrage européen, de suspendre les Autorisations de Mise sur le Marché (AMM) de 11 spécialités en raison de « sérieuses réserves sur l’intégrité des données issues des essais de bioéquivalence menés sur les deux sites indiens (Chennai et Coimbatore) du centre de recherche Micro Therapeutic Research (MTR) Labs ».
Ces mesures de suspension, qui ont prises effet le 3 mai 2017, sont prises « à titre de précaution. Aucun élément n’a, à ce jour, conduit à établir un risque avéré pour la santé humaine ou un manque d’efficacité de ces médicaments », indique l’ANSM dans un point d’information.
Ces suspensions ne concernent que des spécialités contenant les substances actives (ou association de substances actives) suivantes : hydroxyzine et perindopril/indapamide.
« Aucun risque de rupture ou d’interruption de traitement n’est à craindre dans la mesure où ces médicaments sont disponibles sous d’autres marques », précise l’ANSM.
Le Comité des médicaments à usage humain (CHMP) de l’Agence européenne des médicaments (EMA) a, lors de sa réunion du mois de décembre 2016, engagé une procédure de réévaluation du rapport bénéfice/risque des spécialités pour lesquelles les études cliniques ont été menées sur les deux sites indiens de la société MTR (situés à Chennai et à Coimbatore). Cette revue fait suite à une inspection conduite en février 2016 par les autorités autrichiennes et néerlandaises qui ont mis en évidence des manquements aux Bonnes Pratiques Cliniques (irrégularités dans des documents associés à des études de bioéquivalence réalisées sur une période comprise entre juin 2012 et juin 2016 ainsi que dans le système de gestion des données). Ces manquements remettent en cause la fiabilité des résultats des études de bioéquivalence conduites sur les deux sites de la société MTR.
A l’issue de la procédure de réévaluation, le CHMP lors de sa réunion de mars 2017 a considéré que les défaillances ôtaient toute validité scientifique aux études de bioéquivalence menées sur ces deux sites entre juin 2012 et juin 2016. Le CHMP a ainsi recommandé la suspension des autorisations de mise sur le marché (AMM) des spécialités dont le dossier d’AMM était fondé sur la base de ces études dès lors qu’il n’y avait pas d’autres éléments permettant de justifier la démonstration de la bioéquivalence.
« Comme le prévoit la réglementation européenne, dans l’attente de la décision finale de la Commission européenne, les Etats membres peuvent prendre des mesures nationales de suspension des AMM des médicaments concernés présents sur leur marché », rappelle l’ANSM.
Les Onze spécialités commercialisées en France concernées
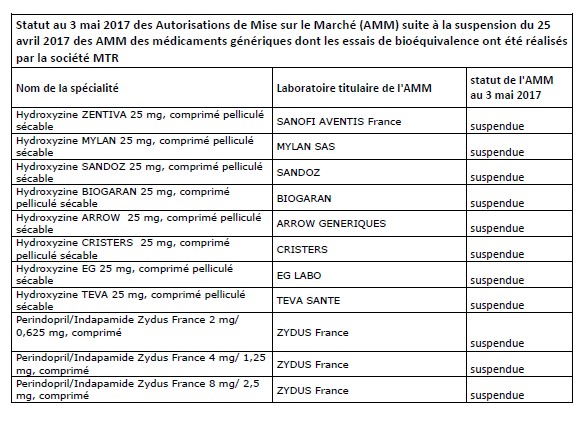
Les lots de ces produits présents dans les officines, dans les établissements de santé et chez les grossistes répartiteurs font l’objet d’un rappel.
Source et visuel : ANSM
