Le Top 10 des médicaments les plus vendus en France
 Dans son analyse des dépenses de médicaments de ville en 2012, l’Assurance Maladie établit le Top 10 des médicaments qui totalisent 2,74 mds € de remboursements. Un classement en forte évolution par rapport à 2011, avec la générication de molécules-clés.
Dans son analyse des dépenses de médicaments de ville en 2012, l’Assurance Maladie établit le Top 10 des médicaments qui totalisent 2,74 mds € de remboursements. Un classement en forte évolution par rapport à 2011, avec la générication de molécules-clés.
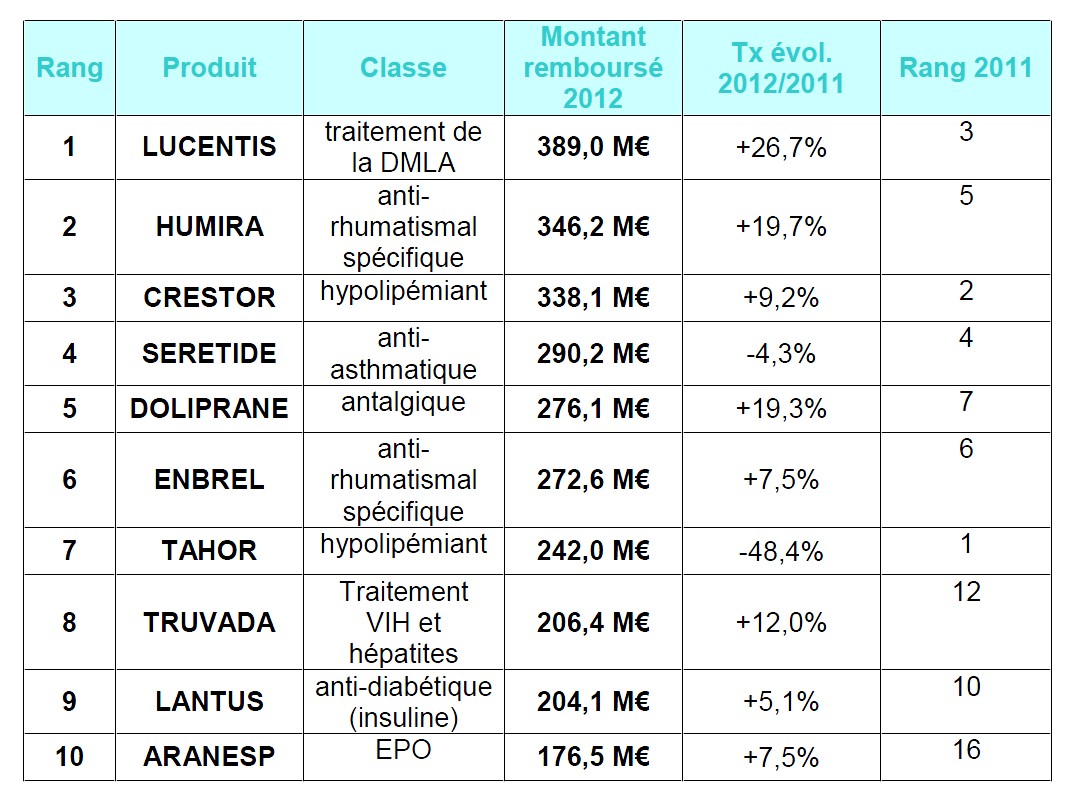
En 2012, le 1er médicament de ville remboursé est le Lucentis®, médicament indiqué dans la dégénérescence maculaire liée à l’âge (DMLA), avec près de 390 M€ remboursés et une progression très forte (+30% environ). La récente étude GEFAL réalisée par les Hospices civils de Lyon et en partie financée par l’Assurance Maladie conclut à une efficacité similaire du bévacizunab (Avastin®) et duranibizumab (Lucentis®) : dans ce cadre et compte-tenu des économies potentielles, l’Assurance Maladie indique qu’elle est « favorable à l’octroi d’une recommandation temporaire d’utilisation (RTU) pour Avastin® dans la DMLA, possibilité offerte par la LFSS 2013 ».
– Crestor® occupe la 3ème place de ce classement (338,1 M€), enregistrant une croissance également soutenue (+9,2%, soit +30 M€) alors même que la HAS a évalué son ASMR au stade V, c’est-à-dire n’apportant pas d’amélioration du service médical rendu comparativement aux autres traitements disponibles sur le marché. « Une étude de l’Assurance Maladie montre par ailleurs qu’il n’existe pas de différence d’efficacité en termes de morbimortalité en prévention primaire, entre la rosuvastatine 5 mg (Crestor®) et la simvastatine 20 mg », souligne la CNAM.
Entre 2008 et 2012, les montants remboursés liés à ce médicament ont cependant progressé de 100 M€, passant de 240 à 338 M€.
– Doliprane® (5ème rang) continue en 2012 d’enregistrer une hausse importante de ses dépenses remboursées (+19,3% et +12,8% en 2011), liée en partie au retrait du Di-Antalvic® et à la hausse tendancielle des volumes prescrits de paracétamol (+5 à 6% annuels), qui ne se dément pas.
– Après sa générication en avril 2012, Tahor® passe de la 1ère à la 7ème place du classement, avec une chute de près de 50% en montants remboursés. Ce résultat illustre l’évolution importante de ce classement entre 2011 et 2012 et l’impact des générications sur les molécules-clés.
Source : CNAM
