Recherche clinique : la France maintient globalement sa position en 2014
 Selon la 7e enquête « Attractivité de la France pour la recherche clinique internationale » (*), réalisée à l’initiative du Leem, la France continue en 2014 de compter parmi les grands acteurs de la recherche clinique mondiale avec 10 % des études internationales réalisées en France (toutes études confondues). Elle représente 5,9 % des patients inclus dans les études internationales menées par les industriels.
Selon la 7e enquête « Attractivité de la France pour la recherche clinique internationale » (*), réalisée à l’initiative du Leem, la France continue en 2014 de compter parmi les grands acteurs de la recherche clinique mondiale avec 10 % des études internationales réalisées en France (toutes études confondues). Elle représente 5,9 % des patients inclus dans les études internationales menées par les industriels.
Selon ce nouvel état des lieux de la recherche menée par l’industrie pharmaceutique, le pourcentage d’études de phase II/III proposées aux filiales française a augmenté pour atteindre 58 % en 2014 versus 43 % en 2012. La France est particulièrement bien positionnée dans trois aires thérapeutiques : cancérologie, maladies rares et infectiologie. En effet, sur les 563 études réalisées en France par les industriels, le pourcentage d’études dans les domaines de l’oncologie et de l’onco/hématologie s’est accru passant de 30 % en 2012 à 38 % en 2014.
L’aire thérapeutique oncologie et onco/hématologie voit aussi son poids augmenter en nombre de patients, passant de 4 070 patients inclus en 2012 (toutes phases confondues) à 5 149 patients en 2014.
Les études (toutes phases confondues) concernant les cancers du sein et de la peau regroupent un nombre important de patients par étude, 52 pour le cancer du sein, 35,4 pour le cancer de la peau, chiffres largement supérieurs au nombre moyen de patients recrutés, 26 en moyenne par étude, pour les cancers dits solides.
Les pourcentages d’études menées dans le domaine de l’infectiologie (14 % toutes phases confondues) et dans le domaine des maladies rares (8 % toutes phases confondues) restent important, consolidant la position de la France dans ces aires thérapeutiques.
Certaines aires thérapeutiques quasiment « abandonnées ».
Les champs du cardiovasculaire et du diabète/métabolisme font en revanche figure de parents « pauvres ». En effet, ces derniers poursuivent une régression amorcée depuis 2008 avec des performances largement en-dessous des moyennes mondiales et européennes. Le nombre moyen de patients par étude s’établit 28 alors que la moyenne européenne est à 59 et la moyenne Monde à 78. De même, le nombre moyen de patients par centre culmine à 4,2 alors que les moyennes Europe et Monde sont de 7 et 6,9. Enfin, la vitesse de recrutement est de 0,6 alors que la moyenne monde est à 1,2 et la moyenne Europe 1,3.
Si les performances de la France sont en baisse, que ce soit en nombre moyen de patients par étude, en nombre moyen de patients par centre et en vitesse de recrutement (nombre de patients par centre et par mois), la position française se maintient dans le contexte mondial et européen de diminution générale des ratios de performances en recherche clinique.
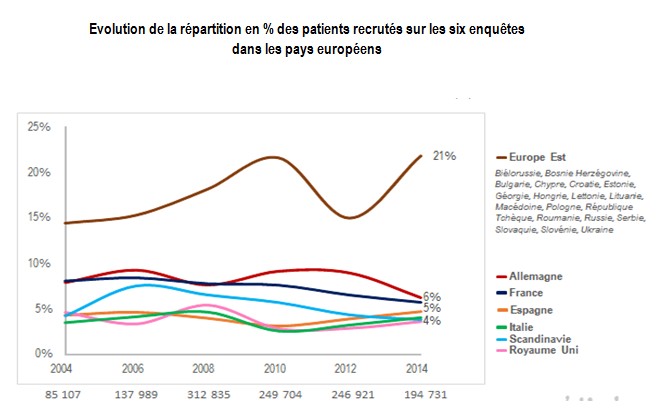
En effet, comme ses voisins européens, la France doit faire face à la puissance Nord-Américaine. L’Amérique du Nord reste en effet l’un des principaux compétiteurs de l’Europe tandis que sur le continent européen, la « vieille » Europe, Allemagne, Grande-Bretagne, France, Espagne, Italie… doit faire face à la montée notable de l’Europe de l’Est en 2014.
Mais, selon le Leem, la position de la France doit aujourd’hui être renforcée : « Augmentation des délais de mise en place des essais, recul de certaines aires thérapeutiques, diminution des ratios de performance… le Leem appelle tous les acteurs de la recherche tant publique que privée à se mobiliser pour consolider, fluidifier et valoriser la recherche clinique dans son rôle pivot dans l’innovation de demain » indique Michel Joly, Président de la Commission des affaires scientifiques du Leem.
S’appuyer sur « une synergie entre les acteurs et une simplification des processus »
« En matière de qualité de l’infrastructure et du système de santé, la perception de la France reste globalement satisfaisante, en dépit de l’accroissement sensible des délais de mise en place des essais », note le Leem. L’enquête 2014 montre en effet une augmentation des délais d’approbation des Comités de protection des personnes (CPP), le délai médian passant de 54 jours en 2012 à 62 jours en 2014, soit une augmentation de 14,8 %. De même, le délai médian entre la soumission du dossier de recherche clinique à l’ANSM et son autorisation est passé de 49 jours à 55 jours, soit une augmentation de 12,2 %.
Plus inquiétant, les délais de signature du premier contrat hospitalier ont augmenté de 9,4 % entre 2012 et 2014, portant le délai médian à 122,5 jours. C’est un vrai retour en arrière en matière de délais de signature des contrats hospitaliers : la France est revenue aux chiffres de l’enquête 2008.
La vitesse de recrutement, soit le nombre de patients recrutés par centre et par mois, qui est de 1 en France, reste au-dessus des moyennes Monde et Europe, qui sont de 0,9, ce qui démontre que lorsque la France est en mesure de démarrer un essai, elle est performante pour recruter des patients. Elle est surtout pénalisée par les délais avant le démarrage de l’essai.
« L’amélioration des délais et des performances françaises ne se décrète pas. Il faut fluidifier le système, le simplifier grâce à une meilleure synergie entre acteurs de la recherche clinique : industriels bien sûr mais aussi, médecins investigateurs, hôpitaux, patients, chercheurs, autorités administratives, CPP…C’est ce que nous tentons de faire, par la mise en place du contrat unique, mesure que nous avons fait avancer via le Comité stratégique de filière, reprise par l’instruction ministérielle de la DGOS, et qui s’applique depuis juin 2014″. Le contrat unique cible expressément le problème des délais avant le démarrage des essais, en proposant un processus administratif simplifié » affirme Patrick Errard, Président du Leem.
L’étude complète est disponible en téléchargement
(*) La 7e enquête du Leem, établie en 2014, dresse un état des lieux de la recherche menée par l’industrie pharmaceutique, effectuée sur le sol français entre le 1e janvier 2012 et le 31 décembre 2013.

