Unidoses : l’ANSM alerte sur les risques de confusion
 Afin d’alerter les professionnels de santé et le grand public, notamment les parents, l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) lance une campagne de sensibilisation sur les risques d’erreurs médicamenteuses liés à une confusion entre des dosettes (unidoses), ayant pu entraîner des effets indésirables.
Afin d’alerter les professionnels de santé et le grand public, notamment les parents, l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) lance une campagne de sensibilisation sur les risques d’erreurs médicamenteuses liés à une confusion entre des dosettes (unidoses), ayant pu entraîner des effets indésirables.
Parmi les signalements d’erreur, plus de la moitié ont entraîné la survenue d’effets indésirables, dont 1/5ème d’effets indésirables considérés comme graves. Ces erreurs, qui concernent majoritairement les nourrissons et enfants, ont lieu principalement au domicile et sont réalisées par les parents ou par l’entourage.
Aujourd’hui de nombreux produits sont présentés sous la forme de dosettes (unidoses), tels que des médicaments : l’eau oxygénée, l’acide borique /borax, les collyres ophtalmiques, tels que des dispositifs médicaux : le sérum physiologique (pour le lavage des yeux et du nez), les produits d’entretien des lentilles, tels que des cosmétiques : le savon (pour le nettoyage de la peau) ou encore des biocides : la chlorhexidine (pour la désinfection de la peau).
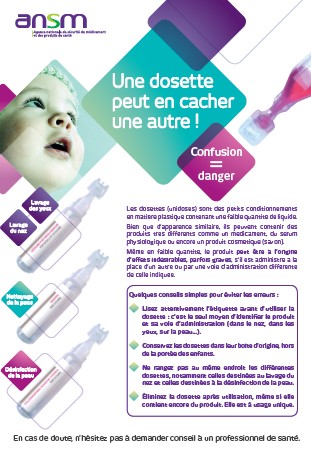
« Ces unidoses sont destinées à être administrées, en totalité ou partiellement, et doivent être éliminées après l’utilisation. Les modalités d’administration des unidoses nécessitent une vigilance particulière des professionnels de santé ainsi que des utilisateurs, particulièrement les parents en cas d’utilisation pour des jeunes enfants, afin d’éviter tout risque de confusion entre deux unidoses ou une administration par une voie d’administration différente de celle indiquée », met en garde l’ANSM.
A cet effet, l’ANSM lance une campagne d’information et de sensibilisation destinée au grand public, notamment les parents de jeunes enfants, et aux professionnels de santé via la diffusion d’une affichette proposant différents conseils pour limiter le risque de confusion entre unidoses.
Afin d’éviter ces erreurs, l’ANSM conseille notamment de lire attentivement les mentions inscrites sur l’étiquette des unidoses et vérifier la voie d’administration du produit, de ne pas identifier le produit uniquement par sa présentation sous forme d’unidose.
Il faut également conserver les unidoses dans leur boîte d’origine (hors de la portée et de la vue des enfants) et ne pas ranger au même endroit les unidoses destinées au lavage de nez ou des yeux, comme le sérum physiologique, et celles destinées à la désinfection de la peau, comme la chlorhexidine. Enfin il est conseillé de jeter l’unidose après son utilisation, même si elle contient encore du produit, puisqu’elle est à usage unique.
Consulter l’affichette : « Une dosette peut en cacher une autre ! » (24/11/2014) et le poster : Erreurs médicamenteuses liées aux conditionnements sous forme unidose : attention, une unidose peut en cacher une autre (01/10/2014)
Source : ANSM
