Sanofi lance une application mobile pour aider à gérer son diabète en voyage
 Sanofi lance DiabVoyage®, la 1ère application mobile pour aider à gérer son diabète en voyage. Cette innovation e-santé a été développée par Sanofi en partenariat avec l’association World Diabetes Tour. Elle centralise les informations, les conseils et les documents nécessaires à la bonne préparation et au bon déroulement des voyages des personnes diabétiques.
Sanofi lance DiabVoyage®, la 1ère application mobile pour aider à gérer son diabète en voyage. Cette innovation e-santé a été développée par Sanofi en partenariat avec l’association World Diabetes Tour. Elle centralise les informations, les conseils et les documents nécessaires à la bonne préparation et au bon déroulement des voyages des personnes diabétiques.
En 2015[1], la France comptait 3,5 millions de personnes diabétiques traitées (soit 5,4% de la population). Pour ces personnes, maintenir un équilibre glycémique est un exercice difficile au quotidien et l’est davantage lorsqu’elles envisagent de voyager. Les changements de repères ont un impact conséquent dans la gestion du quotidien des personnes diabétiques, de type 1 comme de type 2, astreintes à des prises de traitement régulières et au contrôle de leur régime alimentaire.
Avec DiabVoyage® Sanofi a décidé de concrétiser une solution d’accompagnement sous la forme d’une application mobile gratuite et consultable dans toutes les situations. Cet outil digital apporte des réponses concrètes aux nombreuses questions pratiques que se posent les personnes diabétiques lors de la préparation de leur séjour ou une fois en vacances.
Une collaboration entre les équipes de Sanofi, des associations de patients et de nombreux experts scientifiques
L’idée de cette application mobile a émergé lors d’un Hackathon. Les équipes de Sanofi, en collaboration avec Delphine Arduini, patiente-experte et présidente de l’association World Diabetes Tour (WDT), ont porté ce projet, accompagnées de l’agence digitale Interaction Healthcare, de l’association d’Aide aux Jeunes Diabétiques (AJD) pour le contenu concernant les enfants, de deux diabétologues, le Pr. Éric Renard (CHU de Montpellier) et le Dr. Clara Bouché (Hôpital Lariboisière, Paris) ainsi que de Jacqueline Delaunay, diététicienne (CHU Toulouse).
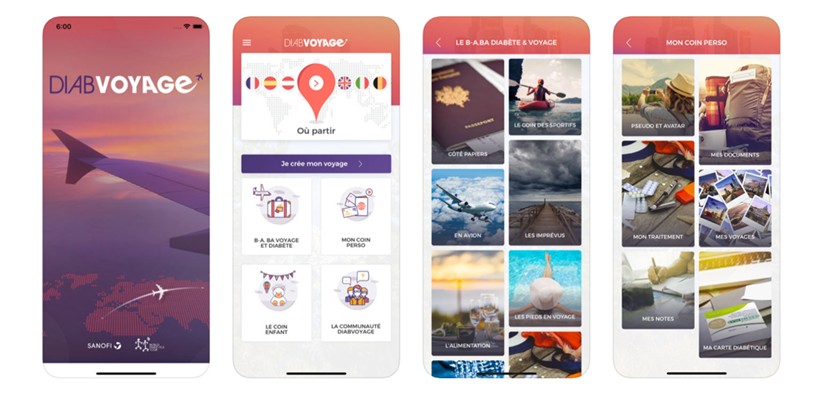
L’application mobile DiabVoyage®
L’application mobile DiabVoyage® accompagne le patient en amont et pendant le voyage sur les nombreuses questions pratiques liées au diabète et au traitement. A l’inscription, le patient (ou l’accompagnant) peut saisir les données liées à son traitement (ou à celui de la personne qu’il accompagne). A partir d’un écran d’accueil simple, il peut ensuite accéder aux différentes fonctionnalités de l’application :
· Les informations nécessaires pour bien préparer son voyage : les papiers à avoir avec soi (dont l’application prévoit la numérisation), la quantité de consommable à emporter selon son traitement et la durée de son séjour, des conseils de conservation de l’insuline, ainsi que toutes les données relatives aux trajets en avions et aux contrôles aux aéroports.
· Des renseignements spécifiques selon le pays de destination : vaccinations recommandées, informations sur l’alimentation locale, la traduction des phrases indispensables dans la langue du pays visité, les numéros et les adresses d’urgence.
· Une rubrique dédiée aux enfants pour fournir une aide supplémentaire aux parents d’enfants diabétiques.
· Un espace d’échange et de témoignage de la communauté des DiabVoyageurs où patients et accompagnants peuvent partager leur expérience et se rassurer mutuellement dans leur envie de voyager.
Au travers de ces nombreuses informations et de l’espace d’échange, l’application adopte une tonalité simple et positive. Elle propose aussi de nombreuses informations qui ne sont pas uniquement d’ordre médical, afin de véhiculer les dimensions positives du voyage auprès des patients, et ne pas les circonscrire à leur condition de malade.
Visionnez la présentation vidéo de l’application
Téléchargez DiabVoyage sur les différentes plateformes Google Play / App Store
____________
1 – BEH N° 27-28 | 14 novembre 2017
Source : Sanofi

